
钡(Ba)和锶(Sr)及其化合物在工业上有着广泛的应用,它们在地壳中常以硫酸盐的形式存在,BaSO4和SrSO4都是难溶性盐。工业上提取钡和锶时首先将BaSO4和SrSO4转化成难溶弱酸盐。已知:
SrSO4(s) Sr2+(aq)+SO42-(aq) Ksp=2.5×10-7
Sr2+(aq)+SO42-(aq) Ksp=2.5×10-7
SrCO3(s) Sr2+(aq)+CO32-(aq) Ksp=2.5×10-9
Sr2+(aq)+CO32-(aq) Ksp=2.5×10-9
(1)将SrSO4转化成SrCO3的离子方程式为________________________,该反应的平衡常数表达式为____________;该反应能发生的原因是_________________________________________________________________________________________________________________________________________________。(用沉淀溶解平衡的有关理论解释)
(2)对于上述反应,实验证明增大CO32-的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”、“减小”或“不变”):
①升高温度,平衡常数K将________;
②增大CO32-的浓度,平衡常数K将________。
(3)已知,SrSO4和SrCO3在酸中的溶解性与BaSO4和BaCO3类似,设计实验证明上述过程中SrSO4是否完全转化成SrCO3。
实验所用的试剂为________;实验现象及其相应结论为_____________________。
科目:高中化学 来源: 题型:填空题
(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈________(填“酸性”、“中性”或“碱性”),溶液中c(Na+)________c(CH3COO-)(填“>”、“=”或“<”)。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈________(填“酸性”、“中性”或“碱性”),溶液中c(Na+)________c(CH3COO-)(填“>”、“=”或“<”)。
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中CH3COO-和Na+浓度相等,则混合后溶液呈________(填“酸性”、“中性”或“碱性”),醋酸体积________氢氧化钠溶液体积(填“大于”、“等于”或“小于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某二元酸(化学式用H2B表示)在水中的电离方程式是H2B=H++HB-;HB-??H++B2-。回答下列问题。
(1)Na2B溶液显________(填“酸性”、“中性”或“碱性”),理由是________________(用离子方程式表示)。
(2)在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
(3)已知0.1 mol·L-1 NaHB溶液的pH=2,则0.1 mol·L-1 H2B溶液中的氢离子的物质的量浓度可能________0.11 mol·L-1(填“<”、“>”或“=”),理由是_________________________________________________________________。
(4)0.1 mol·L-1 NaHB溶液中各种离子浓度由大到小的顺序是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
常温下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。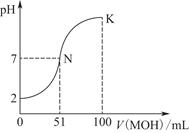
回答下列问题:
(1)由图中信息可知HA为________酸(填“强”或“弱”),理由是________________________________________________。
(2)常温下一定浓度的MA稀溶液的pH=a,则a________________________________________________________7
(填“>”“<”或“=”),用离子方程式表示其原因为_____________________________________________________
此时,溶液中由水电离出的c(OH-)=________。
(3)请写出K点所对应的溶液中离子浓度的大小关系:_________________________________________。
(4)K点对应的溶液中,c(M+)+c(MOH)________2c(A-)(填“>”“<”或“=”);若此时溶液中,pH=10,则c(M+)-c(OH-)=________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某兴趣小组为探究沉淀溶解平衡的原理并测定某温度下PbI2溶度积常数,设计如下实验。
Ⅰ 取100mL蒸馏水,加入过量的PbI2固体(黄色),搅拌,静置,过滤到洁净的烧杯中,得到滤液。
(1)搅拌的目的是 。
(2)取少量滤液于试管中,向其中滴加几滴0.1 mol·L-1KI溶液,观察到的现象是 ,溶液中c(Pb2+) (填“增大”、“减小”或“不变”)。
Ⅱ 准确量取10.00mL滤液,与离子交换树脂(RH)发生反应:2RH + Pb2+= R2Pb + 2H+,交换完成后,流出溶液用中和滴定法测得n(H+)=3.000×10-5 mol。
(3)在此实验温度下,PbI2的溶度积常数Ksp= 。
(4)若步骤Ⅰ盛装滤液的烧杯中有少量水,Ksp测定结果将会 (填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
亚磷酸(H3PO3)是二元酸,与足量NaOH溶液反应生成Na2HPO3。
(1)PCl3水解可制取亚磷酸:PCl3+3H2O===H3PO3+________。
(2)H3PO3溶液中存在电离平衡:H3PO3 H++H2PO3—。
H++H2PO3—。
①某温度下,0.10 mol·L-1的H3PO3溶液pH=1.6,即溶液中c(H+)=2.5×
10-2 mol·L-1。求该温度下上述电离平衡的平衡常数K,写出计算过程。(H3PO3的第二步电离忽略不计,结果保留两位有效数字)
②根据H3PO3的性质可推测Na2HPO3稀溶液的pH________7(填“>”“=”或“<”)。
(3)亚磷酸具有强还原性,可使碘水褪色。该反应的化学方程式为________。
(4)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下:
①阴极的电极反应式为________________________;
②产品室中反应的离子方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)物质的量浓度相同的三种盐NX、NaY、NaZ的溶液,其pH依次为8、9、1 0,则HX、HY、HZ的酸性由强到弱的顺序是 。
(2)比较下列溶液的pH(填“>”“<”或“=”):
①0.1 mol·L-1Na2CO3溶液 0.1 mol·L-1NaHCO3溶液
②0.1 mol·L-1NH4Cl溶液 0.01 mol·L-1NH4C1溶液
(3)把a、b、c、d四块金属片浸泡在稀H2SO4中,用导线两两相连,可以组成各种原电池。若a、b相连,a为负极;c、d相连,c为负极;a、c相连,c为正极;b、d相连,b为正极,则这四种金属的活动性由强到弱的顺序为 。
(4)将AlCl3溶液蒸干、灼烧,最后所得的固体的主要成份是 。
(5)氯化铁溶液呈 性(填“酸”、“碱”或“中”),原因是(用离子方程式表示):
(6)向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-刚好沉淀完全时,溶液的pH 7(填“>”“<”或“=”),离子反应总方程式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)如图是甲烷燃料电池原理示意图,回答下列问题: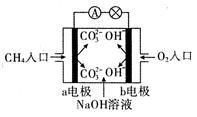
①电池的负极是 (填“a”或“b” )极,该极的电极反应式是 。
② 电池工作一段时间后电解质溶液的pH (填“增大”、“减小”或“不变”)。
(2)利用甲烷燃料电池及下图所示的装置完成电解饱和食盐水的实验,要求测定产生的氢气的体积,并检验氯气的氧化性。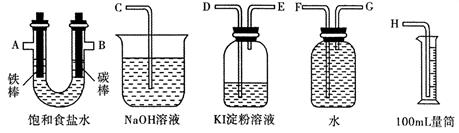
①设计上述实验装置时,各接口的正确连接顺序为: 接 、 接 A 、 B 接 、 接 。
②实验中,在盛有 KI 淀粉溶液的容器中发生反应的离子方程式为 。
③已知饱和食盐水50mL,某时刻测得 H2体积为56mL (标准状况),此时溶液 pH 约为
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)25℃时,pH=12.0的KOH溶液中,由水电离出的C(OH-)=_______mol/L;pH=12.0的K2CO3溶液中,由水电离出来的C(OH-)=_______mol/L。
(2)常温下0.1mol·L-1 CH3COONa溶液PH=8
①用离子方程式表示CH3COONa溶液PH=8的原因:
②按物质的量浓度由大到小顺序排列该溶液中各种微粒(水分子除外)
(3)FeCl3的水溶液呈 (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示): , 实验室在配制FeCl3的溶液时,常将FeCl 3固体先溶于 中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解,否则得到的是浑浊的溶液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com