
亚磷酸(H3PO3)是二元酸,与足量NaOH溶液反应生成Na2HPO3。
(1)PCl3水解可制取亚磷酸:PCl3+3H2O===H3PO3+________。
(2)H3PO3溶液中存在电离平衡:H3PO3 H++H2PO3—。
H++H2PO3—。
①某温度下,0.10 mol·L-1的H3PO3溶液pH=1.6,即溶液中c(H+)=2.5×
10-2 mol·L-1。求该温度下上述电离平衡的平衡常数K,写出计算过程。(H3PO3的第二步电离忽略不计,结果保留两位有效数字)
②根据H3PO3的性质可推测Na2HPO3稀溶液的pH________7(填“>”“=”或“<”)。
(3)亚磷酸具有强还原性,可使碘水褪色。该反应的化学方程式为________。
(4)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下:
①阴极的电极反应式为________________________;
②产品室中反应的离子方程式为_____________________。
科目:高中化学 来源: 题型:填空题
某温度(t ℃)时,水的离子积为KW=1.0×10-13mol2·
L-2,则该温度(填“大于”、“小于”或“等于”)________25 ℃,其理由是
____________________________________________________________。
若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比:
(1)若所得混合液为中性,则a∶b=________;此溶液中各种离子的浓度由大到小排列顺序是____________________。
(2)若所得混合液的pH=2,则a∶b=________。此溶液中各种离子的浓度由大到小排列顺序是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
活性ZnO在橡胶、塑料、涂料工业中有重要应用,一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下(已知:碱式碳酸锌经焙烧可制得活性ZnO): 
已知:几种离子生成氢氧化物沉淀时的pH如表:
请回答下列问题:
(1)步骤A加H2O2发生反应的离子方程式是 ,该步骤需控制溶液pH的范围是 。
(2)A溶液中主要含有的溶质是 。
(3)碱式碳酸锌经焙烧制得活性ZnO的反应ΔH>0,该反应能自发进行的原因是ΔS (选填“=”、“>”或“<”)0。
(4)若经处理后的废水pH=8,此时Zn2+的浓度为 mg/L(常温下,Ksp[Zn(OH)2]=1.2×10-17)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知25 ℃时弱电解质的电离平衡常数:
Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13。
(1)将20 mL 0.10 mol·L-1 CH3COOH溶液和20 mL 0.10 mol·L-1的HSCN溶液分别与0.10 mol·L-1的NaHCO3溶液反应,实验测得产生CO2气体体积(V)与时间t的关系如图所示。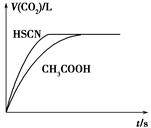
反应开始时,两种溶液产生CO2的速率明显不同的原因是________;反应结束后所得溶液中c(SCN-)________c(CH3COO-)(填“>”、“=”或<)。
(2)2.0×10-3 mol·L-1的氢氟酸水溶液中,调节溶液pH(忽略调节时体积变化),测得平衡体系中c(F-)、c(HF)与溶液pH的关系如图所示。则25 ℃时,HF电离平衡常数为Ka(HF)=________(列式求值)。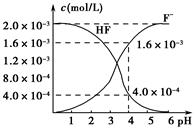
(3)难溶物质CaF2溶度积常数为Ksp=1.5×10-10,将4.0×10-3 mol·L-1 HF溶液与4.0×10-4 mol·L-1的CaCl2溶液等体积混合,调节溶液pH=4(忽略调节时溶液体积变化),试分析混合后是否有沉淀生成?________(填“有”或“没有”),简述理由:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
钡(Ba)和锶(Sr)及其化合物在工业上有着广泛的应用,它们在地壳中常以硫酸盐的形式存在,BaSO4和SrSO4都是难溶性盐。工业上提取钡和锶时首先将BaSO4和SrSO4转化成难溶弱酸盐。已知:
SrSO4(s) Sr2+(aq)+SO42-(aq) Ksp=2.5×10-7
Sr2+(aq)+SO42-(aq) Ksp=2.5×10-7
SrCO3(s) Sr2+(aq)+CO32-(aq) Ksp=2.5×10-9
Sr2+(aq)+CO32-(aq) Ksp=2.5×10-9
(1)将SrSO4转化成SrCO3的离子方程式为________________________,该反应的平衡常数表达式为____________;该反应能发生的原因是_________________________________________________________________________________________________________________________________________________。(用沉淀溶解平衡的有关理论解释)
(2)对于上述反应,实验证明增大CO32-的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”、“减小”或“不变”):
①升高温度,平衡常数K将________;
②增大CO32-的浓度,平衡常数K将________。
(3)已知,SrSO4和SrCO3在酸中的溶解性与BaSO4和BaCO3类似,设计实验证明上述过程中SrSO4是否完全转化成SrCO3。
实验所用的试剂为________;实验现象及其相应结论为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡:
K2SO4·MgSO4·2CaSO4·2H2O(s) 2Ca2++2K++Mg2++4SO42—+2H2O
2Ca2++2K++Mg2++4SO42—+2H2O
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下: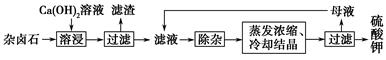
(1)滤渣主要成分有________和________以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:_________________________________________________。
(3)“除杂”环节中,先加入________溶液,经搅拌等操作后,过滤,再加入________溶液调滤液pH至中性。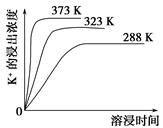
(4)不同温度下,K+的浸出浓度与溶浸时间的关系如图。由图可得,随着温度升高,
①________________________________________________________,
②________________________________________________________。
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+CO32— CaCO3(s)+SO42—
CaCO3(s)+SO42—
已知298 K时,Ksp(CaCO3)=2.80×10-9,
Ksp(CaSO4)=4.90×10-5,求此温度下该反应的平衡常数K(计算结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知25℃时部分弱电解质的电离平衡常数数据如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)25 ℃时,0.1 mol·L-1NaOH溶液的pH为________;
(2)25 ℃时,0.1 mol·L-1NH4Cl溶液的pH________7(填“<”、“=”或“>”),其原因是__________________(用离子方程式表示);
(3)将上述两种溶液等体积混合后,离子浓度大小次序正确的是________(填序号)。
| A.[Na+]>[Cl-]>[OH-]>[H+] |
| B.[Na+]=[Cl-]>[H+]>[OH-] |
| C.[Na+]=[Cl-]>[OH-]>[H+] |
| D.[Cl-]>[Na+]>[OH-]>[H+] |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
酸碱中和滴定在生产实际中有着广泛的应用。室温时,用0.250 mol/LNaOH溶液滴定25.0 mL的一元酸HR溶液时,溶液的pH变化情况如图所示,其中a点表示两种物质恰好完全反应。请回答下列问题:
(1)该一元酸HR溶液的物质的量浓度为_______________。
(2)图中x_____7(填“>”、“<”或“=”),其原因是___________________(用离子方程式表示)。
(3)滴定到a点时,溶液中c(OH-)--c(HR)="____mol/L" (用含x的代数式表示)。
(4)室温时,HR的电离常数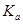 =____________mol/L。
=____________mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com