
酸碱中和滴定在生产实际中有着广泛的应用。室温时,用0.250 mol/LNaOH溶液滴定25.0 mL的一元酸HR溶液时,溶液的pH变化情况如图所示,其中a点表示两种物质恰好完全反应。请回答下列问题:
(1)该一元酸HR溶液的物质的量浓度为_______________。
(2)图中x_____7(填“>”、“<”或“=”),其原因是___________________(用离子方程式表示)。
(3)滴定到a点时,溶液中c(OH-)--c(HR)="____mol/L" (用含x的代数式表示)。
(4)室温时,HR的电离常数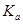 =____________mol/L。
=____________mol/L。
(1)0.20mol/L (2)> R-+H2O HR+OH- (3)10-x (4)5.0×10-6
HR+OH- (3)10-x (4)5.0×10-6
解析试题分析:(1)由于酸碱恰好发生中和反应时:n(NaOH)=n(HR),所以20ml×0.250 mol/L="25.0" mL×C(HR) mol/L,解得C(HR)= 0.20mol/L.(2)反应开始时C(H+)=10-3mol/L<C(HR) =0.20mol/L,说明HR为弱酸。二者恰好反应时生成的盐为强碱弱酸盐,在溶液中发生反应:R-+H2O HR+OH-,所以图中X>7,,溶液显碱性。(3)恰好中和时PH=X。C(H+)=10-Xmol/L,则C(OH-)(总)=KW÷C(H+)=10-14÷10-X=10(X-14)
HR+OH-,所以图中X>7,,溶液显碱性。(3)恰好中和时PH=X。C(H+)=10-Xmol/L,则C(OH-)(总)=KW÷C(H+)=10-14÷10-X=10(X-14)
C(OH-)(总)=C(OH-)(水电离)+C(OH-)(水解)=C(H+)+C(HR),所以C(OH-)(总) --C(HR) =C(H+)=10-Xmol/L。
(4)室温时,在溶液中存在电离平衡HR H++R-,电离常数Ka={C(H+)·C(R-)}÷C(HR)={10-3 mol/L×10-3 mol/L}÷{0.20mol/L-10-3 mol/L }=5.0×10-6 mol/L。
H++R-,电离常数Ka={C(H+)·C(R-)}÷C(HR)={10-3 mol/L×10-3 mol/L}÷{0.20mol/L-10-3 mol/L }=5.0×10-6 mol/L。
考点:考查酸碱中和滴定及强碱弱酸盐溶液中离子浓度的大小比较、弱酸的电离平衡常数等知识。


科目:高中化学 来源: 题型:填空题
亚磷酸(H3PO3)是二元酸,与足量NaOH溶液反应生成Na2HPO3。
(1)PCl3水解可制取亚磷酸:PCl3+3H2O===H3PO3+________。
(2)H3PO3溶液中存在电离平衡:H3PO3 H++H2PO3—。
H++H2PO3—。
①某温度下,0.10 mol·L-1的H3PO3溶液pH=1.6,即溶液中c(H+)=2.5×
10-2 mol·L-1。求该温度下上述电离平衡的平衡常数K,写出计算过程。(H3PO3的第二步电离忽略不计,结果保留两位有效数字)
②根据H3PO3的性质可推测Na2HPO3稀溶液的pH________7(填“>”“=”或“<”)。
(3)亚磷酸具有强还原性,可使碘水褪色。该反应的化学方程式为________。
(4)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下:
①阴极的电极反应式为________________________;
②产品室中反应的离子方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)常温下,将NH3·H2O与盐酸等体积混合,实验数据如下:
| 组别 | NH3·H2O | HCl | 混合溶液的pH值 |
| 甲 | c(NH3·H2O)=0.1mol·L-1 | c(HCl)=0.1mol·L-1 | pH=a |
| 乙 | NH3·H2O的pH=12 | HCl的pH=2 | pH=b |
| 丙 | c(NH3·H2O)="A" mol·L-1 | c(HCl)=0.1mol·L-1 | pH=c |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
今有A.醋酸,B.盐酸, C.硫酸三种酸,请用三种酸的序号和“>”、“<”或“=”填空。
(1)在同体积,同pH的三种酸中,分别加入足量的NaHCO3粉末,在相同条件下产生CO2的体积由大到小的顺序是 。
(2)在同体积、同物质的量浓度的三种酸中,分别加入足量的NaHCO3粉末,在相同条件下产生CO2的体积由大到小的顺序是 。
(3)物质的量浓度均为0.1mol/L的三种酸溶液的pH由大到小的顺序是 ;如果取等体积的0.1mol/L的三种酸溶液,用0.1mol/L的NaOH中和,当恰好完全反应时,消耗NaOH溶液的体积由大到小的顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)25℃时,pH=12.0的KOH溶液中,由水电离出的C(OH-)=_______mol/L;pH=12.0的K2CO3溶液中,由水电离出来的C(OH-)=_______mol/L。
(2)常温下0.1mol·L-1 CH3COONa溶液PH=8
①用离子方程式表示CH3COONa溶液PH=8的原因:
②按物质的量浓度由大到小顺序排列该溶液中各种微粒(水分子除外)
(3)FeCl3的水溶液呈 (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示): , 实验室在配制FeCl3的溶液时,常将FeCl 3固体先溶于 中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解,否则得到的是浑浊的溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)常温下某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,则酸溶液体积V(酸)和碱溶液体积V(碱)的比值关系为 。
(2)现有浓度均为0.1 mol/L的下列溶液:①氢氧化钡;②醋酸;③氢氧化钠;④盐酸,四种溶液中由水电离出的OH—浓度由大到小的顺序是(填序号) 。
(3)已知100℃ KW=10-12,若将此温度下pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2溶液与盐酸的体积之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
求下列混合后溶液的pH:(lg2=0.3 lg5=0.7)
(1)把pH=2和pH=4的两种强酸溶液等体积混合,其pH=_______。
(2)把pH=12和pH=14的两种强碱溶液等体积混合,其pH=_________。
(3)把pH=2的H2SO4溶液和pH=10的NaOH溶液等体积混合,其pH=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有下列物质①Cu;②液态SO2;③CH3COOH;④NaHCO3;⑤Ba(OH)2溶液;⑥熔融NaCl;⑦稀氨水;⑧BaSO4;⑨H2O
(1)属于强电解质的是 (填序号) 属于弱电解质的是 (填序号)
(2)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3―、CO32―、OH―四种微粒的浓度由大到小的顺序为: 。NaHCO3水解的离子方程式 。
(3)Ba(OH)2是一种强电解质,现有25℃、pH=13的Ba(OH)2溶液。
①该Ba(OH)2溶液的物质的量浓度为___________________;
②与某浓度盐酸溶液按体积比(碱与酸之比)1 :9混合后,所得溶液pH=11(假设混合溶液的体积等于混合前两溶液的体积和),该盐酸溶液的pH=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
亚氯酸钠(NaClO2)常用于水的消毒和砂糖、油脂的漂白与杀菌。以下是用过氧化氢法生产亚氯酸钠的工艺流程图: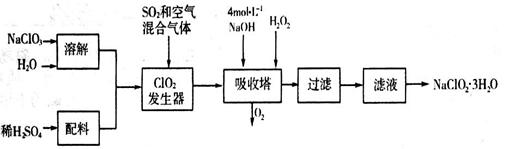
已知:NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
(1)吸收塔内发生反应的化学方程式为_____________________(配平化学方程式)。该工艺流程中的NaClO3、ClO2、NaClO2都是强氧化剂,它们都能和浓盐酸反应制取Cl2。若用二氧化氯和浓盐酸制取Cl2,当生成5 mol Cl2时,通过还原反应制得氯气的质量为________克。
(2)从滤液中得到的NaClO2·3H2O晶体的操作依次是__________(填写序号)。
a.蒸馏 b.灼烧 c.过滤 d.冷却结晶
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
①常温下,物质的量浓度相等的NaClO2、NaF、NaCN、Na2S四种溶液的pH由大到小的顺序为____________;体积相等,物质的量浓度相同的NaF、NaCN两溶液中所含阴阳离子总数的大小关系为:______________(填“前者大”“相等”或“后者大”)。
②Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是_______;当最后一种离子沉淀完全时(该离子浓度为10-5mol·L-1)此时的S2-的浓度为____。
已知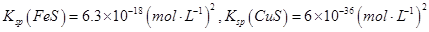
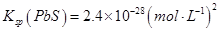
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com