
有下列物质①Cu;②液态SO2;③CH3COOH;④NaHCO3;⑤Ba(OH)2溶液;⑥熔融NaCl;⑦稀氨水;⑧BaSO4;⑨H2O
(1)属于强电解质的是 (填序号) 属于弱电解质的是 (填序号)
(2)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3―、CO32―、OH―四种微粒的浓度由大到小的顺序为: 。NaHCO3水解的离子方程式 。
(3)Ba(OH)2是一种强电解质,现有25℃、pH=13的Ba(OH)2溶液。
①该Ba(OH)2溶液的物质的量浓度为___________________;
②与某浓度盐酸溶液按体积比(碱与酸之比)1 :9混合后,所得溶液pH=11(假设混合溶液的体积等于混合前两溶液的体积和),该盐酸溶液的pH=____________。
科目:高中化学 来源: 题型:填空题
(1)25 ℃时,0.1 mol·L-1NaOH溶液的pH为________;
(2)25 ℃时,0.1 mol·L-1NH4Cl溶液的pH________7(填“<”、“=”或“>”),其原因是__________________(用离子方程式表示);
(3)将上述两种溶液等体积混合后,离子浓度大小次序正确的是________(填序号)。
| A.[Na+]>[Cl-]>[OH-]>[H+] |
| B.[Na+]=[Cl-]>[H+]>[OH-] |
| C.[Na+]=[Cl-]>[OH-]>[H+] |
| D.[Cl-]>[Na+]>[OH-]>[H+] |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
酸碱中和滴定在生产实际中有着广泛的应用。室温时,用0.250 mol/LNaOH溶液滴定25.0 mL的一元酸HR溶液时,溶液的pH变化情况如图所示,其中a点表示两种物质恰好完全反应。请回答下列问题:
(1)该一元酸HR溶液的物质的量浓度为_______________。
(2)图中x_____7(填“>”、“<”或“=”),其原因是___________________(用离子方程式表示)。
(3)滴定到a点时,溶液中c(OH-)--c(HR)="____mol/L" (用含x的代数式表示)。
(4)室温时,HR的电离常数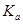 =____________mol/L。
=____________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
为了证明醋酸是弱电解质,甲、乙、丙、丁四人分别选用下列试剂进行实验:
0.10mol/L醋酸溶液、pH=3的盐酸、pH=3的醋酸、NaAC晶体、NaCL晶体、pH试纸、蒸馏水。
(1)甲用pH试纸测出0.10mol/L的醋酸溶液pH=4,则认定醋酸是弱电解质,你认为这一方法正确吗?(填“正确”或“不正确”)
(2)乙取出10ml0.10mol/L的醋酸溶液,用pH试纸测出其pH=a,然后用蒸馏稀释到1000mL,在用pH试纸测定其pH=b,要确定醋酸是弱电解质,则a、b应该满足的关系是 (用“等式”或“不等式”表示)
(3)丙将pH=3醋酸和盐酸,各取10ml,用蒸馏水稀释到原来的100倍,然后用pH试纸测定该溶液的pH,醋酸的变化小,则认定醋酸是弱电解质,你认为这一方法正确吗?
(填“正确”或“不正确”)
(4)丁将pH=3醋酸和盐酸,分别加入相应的钠盐固体,醋酸的PH变化大,则认定醋酸是弱电解质,你认为这一方法正确吗?(填“正确”或“不正确”) 。
(5)戊取pH=3的盐酸和醋酸,分别稀释到原来的100倍,然后加入完全一样的锌粒,醋酸放出H2的速率快,则认定醋酸是弱电解质,你认为这一方法正确吗?(填“正确”或“不正确”) 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
为测定某H2C2O4溶液的浓度,取25.00mL该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定。滴定原理为:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
(1)滴定时,KMnO4溶液应装在 (填“酸式滴定管”或“碱式滴定管” )中,达到滴定终点的现象为 。
(2)若滴定时,没用标准液洗涤滴定管,会使得草酸溶液的物质的量浓度_ _ (填“偏高”“偏低”“无影响”)
(3)若滴定时,反应前后的两次读数分别为a和b,则实验测得所配草酸溶液的物质的量浓度为 mol/L。
(4)在该溶液与KOH溶液反应所得的0.1 mol/L KHC2O4溶液中,c(C2O42-)>c(H2C2O4),下列关系正确的是 。
| A.c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-) |
| B.c(HC2O4-)+ c (C2O42-)+ c(H2C2O4)=0.1mol/L |
| C.c(H+)<c(OH-) |
| D.c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
结合下表回答下列问题(均为常温下的数据):
| 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
| CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
| HClO | 3×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在氯化铁溶液中存在下列平衡:FeCl3+3H2O Fe(OH)3+3HC1;△H>0。回答下列问题:
Fe(OH)3+3HC1;△H>0。回答下列问题:
(1)加热FeCl3溶液,溶液的颜色会不断加深,可得到一种红褐色透明液体,向这种液
体中加入MgCl2溶液,产生的现象为 。
(2)不断加热FeCl3溶液,蒸干其水分并灼烧得到的固体可能是 。
(3)在配制FeCl3溶液时,为防止浑浊,应加入 。
(4)为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入MgCO3固体,过滤
后再加入足量盐酸。MgCO3固体能除去Fe3+的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫酸锌是制备荧光粉的原料之一。工业上由锌白矿(主要成分是ZnO,还含有Fe2O3、CuO、SiO2等杂质)制备ZnSO4?7H2O的流程如下。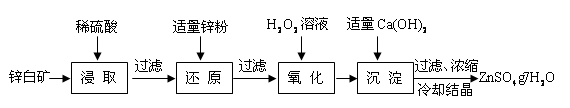
已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式完全沉淀的pH分别为:3.7,6.5,9.7。
(1)浸取过程中提高浸出效率可采用的措施有 (任答一条),
ZnO和硫酸反应的化学方程式为 。
(2)加入适量锌粉的作用为:①使溶液中的Fe3+转化为Fe2+;② 。
(3)氧化过程中H2O2发生反应的离子方程式为 。
(4)加入适量Ca(OH)2调节溶液pH,促进Fe3+水解,Fe3+水解反应的平衡常数表达式
K= ,Ca(OH)2不能过量的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
在一定温度下,测得0.1 mol·L-1CH3COOH溶液的PH为3.0。则CH3COOH在水中的电离度为 ,此温度CH3COOH的电离平衡常数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com