
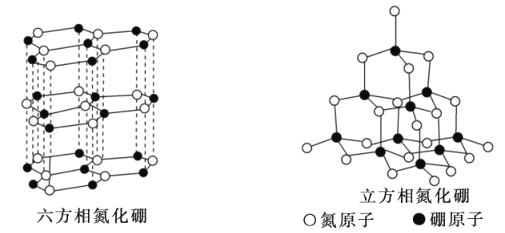
【题目】磷化硼是一种典型的超硬无机材料,常以BCl3、PH3为原料制备,氮化硼(BN)和磷化硼相似。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂,立方相氮化硼是超硬材料,有优异的耐磨性。晶体多种相结构如图所示。
(1)与BCl3分子互为等电子体的一种离子为__(填化学式);预测PH3分子的空间构型为__。
(2)关于氮化硼两种相结构的说法,正确的是__(填序号)。
a.立方相氮化硼含有σ键和π键,所以硬度大
b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的B-N键均为共价键
d.两种晶体均为分子晶体
(3)六方相氮化硼晶体结构与石墨相似却不导电,原因是__;立方相氮化硼晶体中,硼原子的杂化轨道类型为__。
(4)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1molNH4BF4含有__mol配位键。
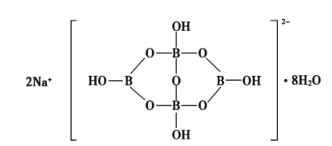
(5)自然界中含硼元素的钠盐是一种天然矿藏,其化学式可以写作Na2B4O710H2O,实际上它的结构单元是由两个H3BO3和两个[B(OH)4]缩合而成的双六元环,应该写成Na2[B4O5(OH)4]8H2O。其结构如图所示,它的阴离子可通过__(填作用力)相互结合形成链状结构。
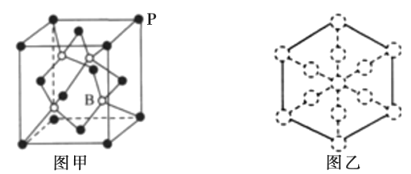
(6)磷化硼晶胞的示意图如图甲所示,其中实心球表示P原子,空心球表示B原子,晶胞中P原子空间堆积方式为__;设阿伏加德罗常数的值为NA,晶胞参数为acm,磷化硼晶体的密度为__gcm-3;若磷化硼晶胞沿着体对角线方向的投影如图乙所示(虚线圆圈表示P原子的投影),请在图乙中用实心圆点画出B原子的投影位置__。
【答案】CO32-或NO3- 三角锥形 bc 层状结构中没有自由移动的电子 sp3 2 氢键 面心立方最密堆积 ![]() =
=![]() =
=![]()
 或
或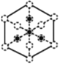
【解析】
(1)寻找与BCl3分子互为等电子体的一种离子时,可将Cl换成O,然后确定另一元素的原子及带电荷;PH3分子的空间构型类似于NH3。
(2)a.立方相氮化硼类似于金刚石,只含有σ键,不含有π键;
b.六方相氮化硼层间作用力小,为范德华力;
c.两种晶体中,B原子与N原子以共价单键相连接;
d.立方相氮化硼为原子晶体,六方相氮化硼为混合型晶体。
(3)石墨能导电,是因为有自由移动的电子,但六方相氮化硼没有;立方相氮化硼晶体中,硼原子的杂化轨道类型类似于金刚石。
(4)1molNH4BF4中,NH4+和BF4-中各含1个配位键。
(5)阴离子中含有电负性较大的O,易形成氢键。
(6)磷化硼晶胞中,P原子分布在面心和顶点,由此可确定空间堆积方式;在磷化硼晶胞中,含有P原子的个数为![]() ×8+
×8+![]() ×6=4,含有B原子个数为4,由此可求出1个晶胞的质量,再由晶胞参数acm,可求出晶胞的体积,由此求出磷化硼晶体的密度;若磷化硼晶胞沿着体对角线方向的投影如图乙所示(虚线圆圈表示P原子的投影),则B原子与面心中的P原子间隔重叠。
×6=4,含有B原子个数为4,由此可求出1个晶胞的质量,再由晶胞参数acm,可求出晶胞的体积,由此求出磷化硼晶体的密度;若磷化硼晶胞沿着体对角线方向的投影如图乙所示(虚线圆圈表示P原子的投影),则B原子与面心中的P原子间隔重叠。
(1)寻找与BCl3分子互为等电子体的一种离子时,可将Cl换成O,然后确定另一元素的原子可以C或N,则离子为CO32-或NO3-;PH3分子的空间构型类似于NH3,中心原子的价层电子对数都为4,其中存在一对孤对电子,所以为三角锥形。答案为:CO32-或NO3-;三角锥形;
(2)a.立方相氮化硼类似于金刚石,只含有σ键,不含有π键,a不正确;
b.六方相氮化硼层间作用力小,为范德华力,所以质地软,b正确;
c.两种晶体中,B原子与N原子以共价单键相连接,c正确;
d.立方相氮化硼为原子晶体,六方相氮化硼为层内相当于原子晶体、层间相当于分子晶体,d不正确;
故选bc。答案为:bc;
(3)石墨能导电,是因为有自由移动的电子,但六方相氮化硼没有,所以不导电,其原因是层状结构中没有自由移动的电子;立方相氮化硼晶体中,硼原子的杂化轨道类似于金刚石,则硼原子的杂化轨道类型为sp3。答案为:层状结构中没有自由移动的电子;sp3;
(4) NH4+和BF4-中各含1个配位键,所以1molNH4BF4中,含有2mol配位键。答案为:2;
(5)阴离子中含有易形成氢键的O、H,所以阴离子可通过氢键相互结合形成链状结构。答案为:氢键;
(6)磷化硼晶胞中,P原子分布在面心和顶点,由此可确定空间堆积方式为面心立方最密堆积;在磷化硼晶胞中,含有P原子的个数为![]() ×8+
×8+![]() ×6=4,含有B原子个数为4,由此可求出1个晶胞的质量,再由晶胞参数acm,可求出晶胞的体积,由此求出磷化硼晶体的密度
×6=4,含有B原子个数为4,由此可求出1个晶胞的质量,再由晶胞参数acm,可求出晶胞的体积,由此求出磷化硼晶体的密度![]() =
=![]() =
=![]() ;若磷化硼晶胞沿着体对角线方向的投影如图乙所示(虚线圆圈表示P原子的投影),则B原子与面心中的P原子间隔重叠,则在图乙中用实心圆点画出B原子的投影位置为
;若磷化硼晶胞沿着体对角线方向的投影如图乙所示(虚线圆圈表示P原子的投影),则B原子与面心中的P原子间隔重叠,则在图乙中用实心圆点画出B原子的投影位置为 或
或 。答案为:面心立方最密堆积;
。答案为:面心立方最密堆积;![]() =
=![]() =
=![]() ;
; 或
或 。
。


科目:高中化学 来源: 题型:
【题目】NaCl是我们生活中必不可少的物质。将NaCl固体溶于水,溶解过程如图所示,下列说法正确的是
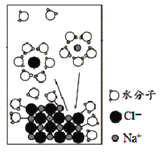
A.该过程发生了分解反应
B.离子从固体表面脱离后不会再回到固体表面
C.水合Na+的图示不科学
D.NaCl溶于水后发生了电离,是在通电条件下进行的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图装置中发生反应的离子方程式为:Zn+2H+=Zn2++H2↑,下列说法错误的是
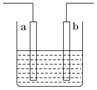
A. a、b不可能是同种材料的电极
B. 该装置可能是电解池,电解质溶液为稀盐酸
C. 该装置可能是原电池,电解质溶液为稀盐酸
D. 该装置可看作是铜-锌原电池,电解质溶液是稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,用0.01molL-1NaOH溶液滴定10mL0.01molL-1H2A溶液的滴定曲线如图所示(已知:25℃时,H2A的Ka1=10-1.75,Ka2=10-7.19)。下列说法不正确的是( )
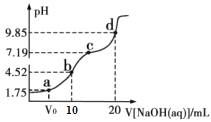
A.a点所得溶液中:V0=5mL
B.B点所得溶液中:c(H2A)+c(H+)= c(A2-)+c(OH-)
C.C点所得溶液中:c(Na+)>3 c(HA-)
D.D点所得溶液中A2-水解平衡常数Kh1=10-6.81
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨晶体结构中的某一种的某一部分。
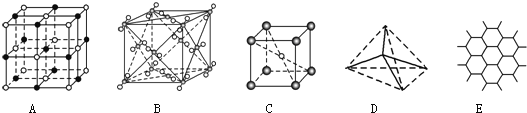
(1)代表金刚石的是________(填字母编号,下同),其中每个碳原子与______个碳原子最近且距离相等;金刚石属于________晶体。
(2)代表石墨的是_______,每个正六边形占有的碳原子数平均为_______个;
(3)代表NaCl的是_______,每个Na+周围与它最近且距离相等的Na+有_______个;
(4)代表CsCl的是_______,它属于_______晶体,每个Cs+与个_______Cl-紧邻;
(5)代表干冰的是_______,它属于_______晶体,每个CO2分子与_______个CO2分子紧邻;
(6)则上述五种物质熔点由高到低的排列顺序为______________(用字母编号回答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层的电子数之和。
(1)C2D电子式为__________,D原子的质子数和中子数相等,D的原子组成符号为______。
(2)用电子式表示A、B两元素形成AB2的过程_______________________________。
(3)E和A的最高价氧化物反应的化学方程式_________________________________。
(4)足量的AB2与C的最高价氧化物对应水化物反应的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次递增且都小于36的X、Y、Z、Q、W五种元素,其中X是原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Q原子基态时2p原子轨道上有2个未成对的电子,W元素的原子结构中3d能级有4个未成对电子。回答下列问题:
(1)Y2X2分子中Y原子轨道的杂化类型为____, Y2X2分子中σ键和π键个数比为_______ 。
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是_____。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是_______。
(4)元素W能形成多种配合物,如:W(CO)5等。
①基态W3+的M层电子排布式为______。
②W(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断W(CO)x晶体属于________(填晶体类型)。
(5)下列有关的说法正确的是________________。
A.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
B.电负性顺序:X<Y<Z<Q
C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D.H2YO3的分子结构中含有一个非羟基氧,故其为中强酸
(6)Q和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为_____。已知该晶胞密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a=_____cm。(用含ρ、NA的计算式表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含铜污泥[主要成分为Cu(OH)2、Cu2(OH)2CO3、Fe(OH)3和SiO2]为原料制备纯净的Cu2(OH)2CO3的工艺流程如下:
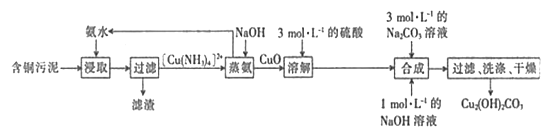
回答下列问题:
(1)为提高浸取率采取的措施是____(填字母)。
a.增大浸取与含铜污泥的投料比 b.减小氨水的浓度
c.缩短浸取的时间 d.适当提高浸取的温度
(2)合成Cu2(OH)2CO3时发生的离子方程式为__________。
(3)第一次过滤时所得滤渣的成分为________(填化学式)。
(4)经检测,该含铜污泥中铜的含量为32%,且上述工艺流程中铜的损耗率为10%,某工厂以20t这种含钢污泥为原料,经上述工艺流程后,最终可制得Cu2(OH)2CO3____t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为____________,3d能级上的未成对电子数为________。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是__________。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为________,提供孤电子对的成键原子是________。
③氨的沸点________(填“高于”或“低于”)膦(PH3),原因是___________;氨是________分子(填“极性”或“非极性”),中心原子的轨道杂化类型为________。
(3)单质铜及镍都是由________键形成的晶体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com