
【题目】东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为____________,3d能级上的未成对电子数为________。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是__________。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为________,提供孤电子对的成键原子是________。
③氨的沸点________(填“高于”或“低于”)膦(PH3),原因是___________;氨是________分子(填“极性”或“非极性”),中心原子的轨道杂化类型为________。
(3)单质铜及镍都是由________键形成的晶体。
【答案】1s22s22p63s23p63d84s2或[Ar]3d84s2 2 正四面体 配位键 N 高于 NH3分子间可形成氢键 极性 sp3 金属
【解析】
(1)Ni是28号元素,其原子核外有28个电子,根据构造原理书写镍元素基态原子的电子排布式;3d能级上的未成对的电子数为2;
(2)①[Ni(NH3)6]SO4中阴离子价层电子对个数=4+![]() =4,且不含孤电子对,根据价层电子对互斥理论判断硫酸根离子的立体构型;
=4,且不含孤电子对,根据价层电子对互斥理论判断硫酸根离子的立体构型;
②含有孤电子对和含有空轨道的原子之间存在配位键,提供孤电子对的成键原子是N;
③有氢键的氢化物熔沸点较高;
氨气分子结构不对称,正负电荷重心不重合;氨气分子中中心原子N原子的价层电子对个数=3+![]() =4且含有一个孤电子对,根据价层电子对互斥理论判断N原子的轨道杂化类型;
=4且含有一个孤电子对,根据价层电子对互斥理论判断N原子的轨道杂化类型;
(3)金属晶体中存在金属键,则该物质中含有金属键。
(1)Ni是28号元素,其原子核外有28个电子,根据构造原理书写镍元素基态原子的电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2;3d能级上的未成对的电子数为2;
(2)①[Ni(NH3)6]SO4中中阴离子SO42-价层电子对个数=4+![]() =4,且不含孤电子对,根据价层电子对互斥理论判断硫酸根离子的立体构型为正四面体;
=4,且不含孤电子对,根据价层电子对互斥理论判断硫酸根离子的立体构型为正四面体;
②含有孤电子对和含有空轨道的原子之间存在配位键,在[Ni(NH3)6]2+中Ni2+提供空轨道、NH3提供孤电子对,所以[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为配位键,提供孤电子对的成键原子是N原子;
③有氢键的氢化物熔沸点较高,氨气中含有氢键、膦中不含氢键,则氨的熔沸点高于膦;
氨气分子结构不对称,正负电荷重心不重合,所以为极性分子;氨气分子中中心原子N原子的价层电子对个数=3+![]() =4,且含有一个孤电子对,根据价层电子对互斥理论判断N原子的轨道杂化类型为sp3杂化;
=4,且含有一个孤电子对,根据价层电子对互斥理论判断N原子的轨道杂化类型为sp3杂化;
(3)单质铜及镍都是金属,由金属阳离子与自由电子之间通过金属键结合,所以晶体中存在金属键。


科目:高中化学 来源: 题型:
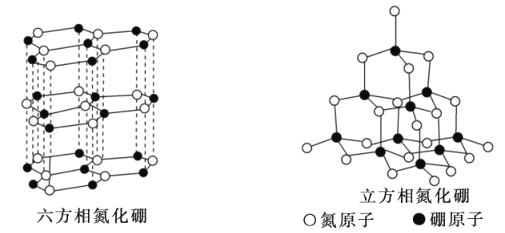
【题目】磷化硼是一种典型的超硬无机材料,常以BCl3、PH3为原料制备,氮化硼(BN)和磷化硼相似。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂,立方相氮化硼是超硬材料,有优异的耐磨性。晶体多种相结构如图所示。
(1)与BCl3分子互为等电子体的一种离子为__(填化学式);预测PH3分子的空间构型为__。
(2)关于氮化硼两种相结构的说法,正确的是__(填序号)。
a.立方相氮化硼含有σ键和π键,所以硬度大
b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的B-N键均为共价键
d.两种晶体均为分子晶体
(3)六方相氮化硼晶体结构与石墨相似却不导电,原因是__;立方相氮化硼晶体中,硼原子的杂化轨道类型为__。
(4)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1molNH4BF4含有__mol配位键。
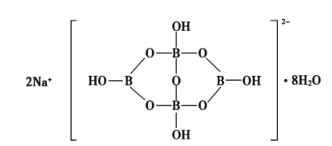
(5)自然界中含硼元素的钠盐是一种天然矿藏,其化学式可以写作Na2B4O710H2O,实际上它的结构单元是由两个H3BO3和两个[B(OH)4]缩合而成的双六元环,应该写成Na2[B4O5(OH)4]8H2O。其结构如图所示,它的阴离子可通过__(填作用力)相互结合形成链状结构。
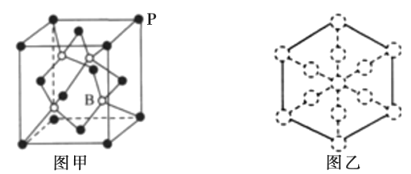
(6)磷化硼晶胞的示意图如图甲所示,其中实心球表示P原子,空心球表示B原子,晶胞中P原子空间堆积方式为__;设阿伏加德罗常数的值为NA,晶胞参数为acm,磷化硼晶体的密度为__gcm-3;若磷化硼晶胞沿着体对角线方向的投影如图乙所示(虚线圆圈表示P原子的投影),请在图乙中用实心圆点画出B原子的投影位置__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题。
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)元素②的原子结构示意图为_____。
(2)元素③、④、⑤、⑥原子半径由大到小为_____。
(3)上述8种元素中,非金属性最强的是_____。
(4)元素②、③形成的气态氢化物稳定性:_____>_____;元素①、③、⑤可形成既含离子键又含极性共价键的化合物,写出其电子式:_____。
(5)元素⑦的最高价氧化物对应的水化物与元素⑤最高价氧化物对应的水化物溶液反应的离子方程式为_____。
(6)从原子结构的角度解释元素③和⑦的非金属性强弱:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质发生变化时,所克服的粒子间相互作用属同种类型的是( )
A.亚硫酸氢钠和硫酸氢钠分别溶解在水中
B.硝酸铵与硝酸分别受热变为气体
C.氯化钠与氯化氢分别溶解在水中
D.碘与干冰分别受热变为气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四个数据都表示合成氨的反应速率,其中速率相等的是( )
①![]() (N2)=0.6mol/(L·min) ②
(N2)=0.6mol/(L·min) ②![]() (NH3)=1.8mol/(L·min)
(NH3)=1.8mol/(L·min)
③![]() (H2)=1.2mol/(L·min) ④
(H2)=1.2mol/(L·min) ④![]() (H2)=0.045mol/(L·s)
(H2)=0.045mol/(L·s)
A. ①②B. ①③C. ③④D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮及其化合物在化工生产和国防工业中具有广泛应用。请回答:
(1)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图:
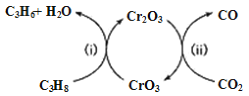
①图中催化剂为__________________。
②该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是______________。
(2)现向三个体积均为2L的恒容密闭容器I、Ⅱ、Ⅲ中,均分别充入1molCO和2molH2发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为T1、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。
CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为T1、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。
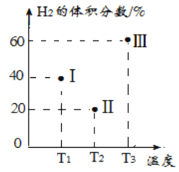
①5min 时三个容器中的反应达到化学平衡状态的是容器__________(填序号)。
②0-5min内容器I中用CH3OH表示的化学反应速率v(CH3OH)=_________。(保留两位有效数字)。
③当三个容器中的反应均达到平衡状态时,平衡常数最小的是容器_________。(填序号)
(3)在密闭容器中充入10molCO和8 molNO,发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)△H=-762kJ·mo-1,如图为平衡时NO的体积分数与温度、压强的关系。
N2(g)+2CO2(g)△H=-762kJ·mo-1,如图为平衡时NO的体积分数与温度、压强的关系。
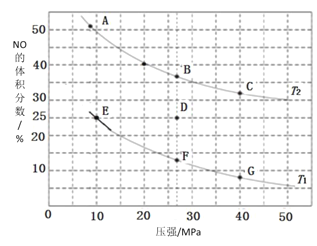
①由上图判断,温度T1_____T2(填“低于”或“高于”)。
②压强为20MPa、温度为T2下,若反应进行到10 min达到平衡状态,在该温度下,如图所示A、B、C对应的pA(CO2)、pB(CO2)、pC(CO2)从大到小的顺序为_________。
③若在D点对反应容器降温的同时缩小体积至体系压强增大,重新达到的平衡状态可能是图中A~G点中的__________点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂排放的工业废水中含Fe3+、Al3+、Cu2+,工厂为了防止环境污染,变废为宝,利用废铁屑和其他化学试剂进行如下操作,得到了绿矾(FeSO4·7H2O)、Al2O3和金属Cu,回答下列问题:

(1)固体C是_________(用化学式表示)。
(2)在过程①中需要通入足量的氯气,该过程中发生反应的离子方程式为__________。
(3)溶液E焰色反应呈黄色,溶液a是______________。
(4)沉淀F→溶液H中所用试剂:②_________,③____________。溶液G→溶液H反应的离子方程式是_______________________。
(5)实验室中由溶液H得到绿矾的操作是:蒸发、浓缩___________、过滤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应由两步反应A![]() B
B![]() C构成,反应过程中的能量变化曲线如图(E1、E3表示两反应的活化能)。下列有关叙述正确的是( )
C构成,反应过程中的能量变化曲线如图(E1、E3表示两反应的活化能)。下列有关叙述正确的是( )

A.三种化合物的稳定性顺序:B﹤A﹤CB.两步反应均为放热反应
C.加入催化剂会改变反应的焓变D.A![]() C的反应的ΔH=E1-E2
C的反应的ΔH=E1-E2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的是( )

A. K1闭合,铁棒上发生的反应为2H++2e-=H2↑
B. K1闭合,石墨棒周围溶液pH逐渐降低
C. K2闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法
D. K2闭合,电路中通过0.4NA个电子时,两极共产生4.48L气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com