
【题目】某工厂排放的工业废水中含Fe3+、Al3+、Cu2+,工厂为了防止环境污染,变废为宝,利用废铁屑和其他化学试剂进行如下操作,得到了绿矾(FeSO4·7H2O)、Al2O3和金属Cu,回答下列问题:

(1)固体C是_________(用化学式表示)。
(2)在过程①中需要通入足量的氯气,该过程中发生反应的离子方程式为__________。
(3)溶液E焰色反应呈黄色,溶液a是______________。
(4)沉淀F→溶液H中所用试剂:②_________,③____________。溶液G→溶液H反应的离子方程式是_______________________。
(5)实验室中由溶液H得到绿矾的操作是:蒸发、浓缩___________、过滤。
【答案】 Cu 2Fe2++Cl2=2Fe3++2Cl— NaOH 稀硫酸 铁粉 2Fe3++Fe=3Fe2+ 冷却、结晶
【解析】加入过量的铁后,铁离子转化为亚铁离子,铜离子被置换出铜,固体A是铜与过量铁的混合物。加入稀硫酸后铁溶解生成硫酸亚铁,过滤得到金属铜,即C是铜。B是硫酸亚铁、硫酸铝的混合溶液,通入氯气把硫酸亚铁氧化为硫酸铁。溶液E焰色反应呈黄色,说明含有钠离子,所以a是氢氧化钠,E是偏铝酸钠与氢氧化钠的混合溶液。F是氢氧化铁,与稀硫酸反应生成硫酸铁,G是硫酸铁溶液,硫酸铁与铁反应生成硫酸亚铁,H是硫酸亚铁溶液。
(1)根据以上分析可知固体C是Cu。(2)在过程①中需要通入足量的氯气,该过程中发生反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-。(3)溶液E焰色反应呈黄色,溶液a是NaOH。(4)沉淀F→溶液H中所用试剂分别是稀硫酸与铁粉;溶液G→溶液H反应的离子方程式是2Fe3++Fe=3Fe2+。(5)实验室中由溶液H得到绿矾的操作是:蒸发、浓缩、冷却、结晶、过滤。


科目:高中化学 来源: 题型:
【题目】已知标准状况下气体摩尔体积为22.4L/mol,但很多化学实验并非在标准状况下进行,而是在常温常压下进行,下图为测定常温常压下气体摩尔体积的实验装置图。图中反应原理为:2C2H5OH+2Na→2C2H5ONa+H2↑(反应放热)。

(1)①该装置有明显错误处,请指出错误之处:_________;
②作图修改(只针对需修改部位):_____________。
(2)经过(1)改正后进行实验,实验过程如下:
a.检查装置气密性;
b.常温常压下,取4.6g乙醇与足量的金属钠反应并利用排水法收集产生的H2(假设广口瓶和量筒足够大);
c.当圆底烧瓶中不再有气泡产生,不能立即读数,必须先_____,后________,再平视读取量筒中收集到水的体积为1240.0mL。经计算常温常压下气体摩尔体积为__________。
(3)经过(1)改正后仍有实验误差,下列哪些选项会导致实验误差_______。
A.收集到的氢气中含有装置中原有的空气
B.收集H2前导管B中无蒸馏水
C.分液漏斗中的无水乙醇进入圆底烧瓶后占用了装置内气体空间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、X、Y、Z的原子序数依次增大。R和X可形成两种液态化合物(常温常压),Y+和X2-具有相同的电子层结构,X和Z位于同一主族。下列说法正确的是
A. 原子半径大小顺序为:r(Y)>r(X)>r(Z)>r(R)
B. R与X形成的两种液态化合物中均只含极性共价键
C. Y与X可形成碱性氧化物Y2X2
D. 由R、X、Y、Z四种元素形成的常见化合物可抑制水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化锌(ZnS)是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取其工艺流程如图所示.

(1)为提高锌灰的浸取率,可采用的方法是______________(填序号)。
①研磨 ②多次浸取 ③升高温度 ④加压 ⑤搅拌
(2)步骤Ⅱ所得滤渣中的物质是(写化学式)_____________。
(3)步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂X应为________。
(4)步骤Ⅳ还可以回收Na2SO4来制取Na2S。
①检验ZnS固体是否洗涤干净的方法是__________________;
②Na2S可由等物质的量的Na2SO4和CH4在高温、催化剂条件下制取,化学反应方程式为_______;
③已知Na2SO4·10H2O及Na2SO4的溶解度随温度变化曲线如图,从滤液中得到Na2SO4·10H2O的操作方法是_________________________________。

(5)若步骤Ⅱ加入的ZnCO3为bmol,步骤Ⅲ所得Cd为dmol,最后得到VL、物质的量浓度为cmol/L的Na2SO4溶液.则理论上所用锌灰中含有锌元素的质量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA,下列有关叙述不正确的是
A. 标准状况下,11.2LHF中含有氟原子的数目为0.5 NA
B. 含1molCl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+数为NA
C. 13g锌与一定量浓硫酸恰好完全反应,生成气体的分子数为0.2 NA
D. 28g乙烯和环丁烷的混合气体中含有的碳原子数为2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生:N2+3H2![]() 2NH3。下列有关说法正确的是( )
2NH3。下列有关说法正确的是( )
A. 达到化学平衡时,正反应和逆反应的速率都为零
B. 当符合:3正N2=正H2时,反应达到平衡状态
C. 达到化学平衡时,单位时间消耗a molN2,同时生成3a molH2
D. 当N2、H2、NH3的分子数比为1∶3∶2,反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两上实验:(N2O4![]() 2NO2 △H > 0)
2NO2 △H > 0)
(a)将两容器置于沸水中加热
(b)在活塞上都加2 kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是( )
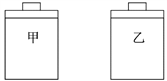
A. (a)甲>乙,(b)甲>乙 B. (a)甲>乙,(b)甲=乙
C. (a)甲<乙,(b)甲>乙 D. (a)甲>乙,(b)甲<乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物体内某些有机物的元素组成可表示如下图,A、B、C代表大分子物质。据图回答下列问题:

(1)a →A过程发生的是_______反应;A可分为A1……A5……,其原因从a分析是由于_______。
(2)大分子物质C是_______;C1 是_______。
(3)B在动、植物细胞内分别主要是_________、_________;b的主要功能是_________。如果只考虑元素,不考虑分子量的大小,B也可能代表动植物体内部存在的___________,此时B的功能为生物体的储能物质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是( )
A. 对该反应体系加热
B. 向溶液中滴加浓硝酸,以增大氢离子浓度
C. 滴加少量CuSO4溶液
D. 改用铁粉
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com