
【题目】阿伏加德罗常数的值为NA,下列有关叙述不正确的是
A. 标准状况下,11.2LHF中含有氟原子的数目为0.5 NA
B. 含1molCl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+数为NA
C. 13g锌与一定量浓硫酸恰好完全反应,生成气体的分子数为0.2 NA
D. 28g乙烯和环丁烷的混合气体中含有的碳原子数为2 NA
【答案】A
【解析】标准状况下,HF为液体,不能根据气体体积来计算其物质的量,A错误;加入一定量的氨水后,溶液呈中性,c(H+)=c(OH-),根据溶液中的电荷守恒:c(Cl-)+c(OH-)=c(NH4+![]() )+c(H+),所以n (NH4+
)+c(H+),所以n (NH4+![]() )=n(Cl-)=1 mol,故此时溶液中NH4+数目为NA,B正确;浓硫酸与锌反应的方程式Zn+2H2SO4
)=n(Cl-)=1 mol,故此时溶液中NH4+数目为NA,B正确;浓硫酸与锌反应的方程式Zn+2H2SO4![]() ZnSO4+SO2↑+2H2O,从方程式可以看出1mol锌生成1mol二氧化硫气体,随着硫酸的消耗和水的生成,硫酸变稀,锌与稀硫酸反应Zn+H2SO4=ZnSO4+H2↑,从中看出1mol锌生成1mol氢气,所以1mol锌无论与浓硫酸反应还是与稀硫酸反应,生成气体都为1mol,13g锌的物质的量为n=
ZnSO4+SO2↑+2H2O,从方程式可以看出1mol锌生成1mol二氧化硫气体,随着硫酸的消耗和水的生成,硫酸变稀,锌与稀硫酸反应Zn+H2SO4=ZnSO4+H2↑,从中看出1mol锌生成1mol氢气,所以1mol锌无论与浓硫酸反应还是与稀硫酸反应,生成气体都为1mol,13g锌的物质的量为n=![]() =
=![]() =0.2mol,生成气体分子数为0.2NA,C正确;28 g乙烯含有碳原子数为28/28×2×NA=2NA,28 g环丁烷含有碳原子数为28/56×4×NA=2NA,所以28 g乙烯和环丁烷的混合气体中含有的碳原子数为2 NA,D正确;正确选项A。
=0.2mol,生成气体分子数为0.2NA,C正确;28 g乙烯含有碳原子数为28/28×2×NA=2NA,28 g环丁烷含有碳原子数为28/56×4×NA=2NA,所以28 g乙烯和环丁烷的混合气体中含有的碳原子数为2 NA,D正确;正确选项A。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】在某容积一定的密闭容器中,可逆反应:A(g)+B(g)![]() xC(g),符合下列图象(Ⅰ)所示关系。由此推断对图(Ⅱ)的正确说法是( )
xC(g),符合下列图象(Ⅰ)所示关系。由此推断对图(Ⅱ)的正确说法是( )
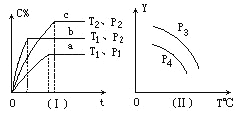
A. P3>P4,Y轴表示A的质量
B. P3<P4,Y轴表示B的百分含量
C. P3>P4,Y轴表示混合气体密度
D. P3>P4,Y轴表示混合气体平均摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜元素位于元素周期表中第ⅠB族,在化合物中其化合价可以呈现+1、+2 价。铜的单质及其化合物在很多领域有重要的应用。
Ⅰ.CuSO4和Cu(NO3)2是常见的+2价铜的化合物,有较为广泛的应用。
(1)向CuSO4溶液中滴加氨水,最后可以得到深蓝色的[Cu(NH3)4]SO4溶液。
①N、O、S三种元素的第一电离能由大到小的顺序为______________________________。
②比较NH3 和[Cu(NH3)4]2+中H-N-H键角的大小:NH3___________[Cu(NH3)4]2+(填“>”或“<”),并说明理由________________________。
(2)制备Cu(NO3)2的一种方法是在N2O4的乙酸乙酯溶液中加入铜,反应一段时间后,加热即可得到Cu(NO3)2。
①NO3- 的立体构型的名称为_______________,N原子的杂化方式为________________。NO3- 的一种等电子体为________________________。
②N2O4会发生类似于水的自偶电离N2O4![]() NO++NO3- ,制备无水Cu(NO3)2的化学方程式为__________________________________________。
NO++NO3- ,制备无水Cu(NO3)2的化学方程式为__________________________________________。
Ⅱ.CuCl是较为常见的+1价铜的化合物。
(3)基态Cu+ 的价层电子排布式为________________________。
(4)CuCl的晶胞结构如图所示,C1原子位于立方体的顶点和面心,Cu原子位于Cl原子构成的四面体体心。
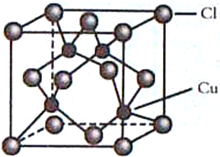
①每个Cl原子周围距Cl原子最近且等距离的Cu原子数目为________________。
②设NA为阿伏加德罗常数的值,晶体的密度为ρg/cm3,CuCl的摩尔质量为M g/mol,计算晶胞中距离最近的两个Cu原子间的距离为___________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级碳酸钙广泛应用于橡胶、塑料、造纸、化学建材、油墨、涂料、密封胶等行业。在CaCl2溶液中通入NH3和CO2可以制得纳米级碳酸钙。某化学兴趣小组设计如图所示装置制取该产品。D中装有蘸有稀硫酸的脱脂棉,图中夹持装置已略去。
可选用的药品有:a.石灰石 b.饱和氯化钙溶液 c.6mol/L盐酸 d.氯化铵e.氢氧化钙

(1)A中制备气体时,所需药品是______(选填字母序号)。
(2)B中盛有_____________溶液,其作用是___________________________。
(3)写出该实验中制取氨气的化学方程式________________________________。
(4)在实验中,向C中通入气体是有先后顺序的,应先通入的气体是_____(填化学式)。
(5)检验D出口处有氨气逸出的方法是_____________________________。
(6)写出制纳米级碳酸钙的化学方程式____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过分别加入AgNO3、Ba(NO3)2、Mg(NO3)2三种试剂,使某溶液中的Cl-、OH-、CO32-先后沉淀出来,逐一加以分离,则加入三种试剂的顺序是
A. AgNO3、Ba(NO3)2、Mg(NO3)2 B. Mg(NO3)2、Ba(NO3)2、AgNO3
C. Ba(NO3)2、AgNO3、Mg(NO3)2 D. Ba(NO3)2、Mg(NO3)2、AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂排放的工业废水中含Fe3+、Al3+、Cu2+,工厂为了防止环境污染,变废为宝,利用废铁屑和其他化学试剂进行如下操作,得到了绿矾(FeSO4·7H2O)、Al2O3和金属Cu,回答下列问题:

(1)固体C是_________(用化学式表示)。
(2)在过程①中需要通入足量的氯气,该过程中发生反应的离子方程式为__________。
(3)溶液E焰色反应呈黄色,溶液a是______________。
(4)沉淀F→溶液H中所用试剂:②_________,③____________。溶液G→溶液H反应的离子方程式是_______________________。
(5)实验室中由溶液H得到绿矾的操作是:蒸发、浓缩___________、过滤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取50.0mL Na2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后,得到沉淀14.51g,将沉淀用过量稀HNO3处理后,沉淀质量减少到4.66g,并有气体放出,试计算:
(1)原溶液中Na2SO4的物质的量为______________;
(2)生成气体的体积(标准状况)为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图1是细胞中化合物含量的扇形图,图2是有活性的细胞中元素含量的柱形图,下列说法不正确的是( )

A. 若图1表示细胞鲜重,则A、B化合物依次是H2O、蛋白质
B. 若图2表示组成人体细胞的元素含量,则a、b、c依次是O、C、H
C. 地壳与活细胞中含量最多的元素都是a,因此说明生物界与非生物界具有统一性
D. 若图1表示细胞完全脱水后化合物的含量,则A化合物具有多样性,其中含的元素为C、H、O、N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)氧化还原法消除NOx的转化如下:
![]()
①反应I为NO +O3===NO2+O2,生成标准状况下11.2 L O2时,转移电子的物质的量是__________mol
②反应Ⅱ中,当n( NO2):n[CO(NH2)2]=3:2时,氧化产物与还原产物的质量比为___________
(2)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素)。装置I中发生反应的离子方程式为____________________________________

(3)装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO3-、NO2-,请写出生成等物质的量的NO3-和NO2-时的离子方程式____________________________________
(4)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的_____________(填“阳极”或“阴极”),同时在另一极生成S2O42一的电极反应式为_________________________________
(5)取少量装置Ⅳ所得的产品溶于水,溶液中离子浓度由大到小的顺序为_________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com