
【题目】在某容积一定的密闭容器中,可逆反应:A(g)+B(g)![]() xC(g),符合下列图象(Ⅰ)所示关系。由此推断对图(Ⅱ)的正确说法是( )
xC(g),符合下列图象(Ⅰ)所示关系。由此推断对图(Ⅱ)的正确说法是( )
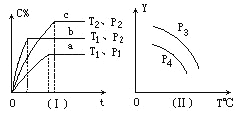
A. P3>P4,Y轴表示A的质量
B. P3<P4,Y轴表示B的百分含量
C. P3>P4,Y轴表示混合气体密度
D. P3>P4,Y轴表示混合气体平均摩尔质量
【答案】D
【解析】
对图(I)用“先拐先平”法确定反应的特点,对图(II)用“定一议二”法分析。
对图(I),取曲线a、b,曲线b先出现拐点,T1、P2条件下反应速率比T1、P1条件下快,则P2![]() P1,T1、P2条件下平衡时C%比T1、P1条件下大,增大压强平衡向正反应方向移动,则x=1;取曲线b、c,曲线b先出现拐点,T1、P2条件下反应速率比T2、P2条件下快,则T1
P1,T1、P2条件下平衡时C%比T1、P1条件下大,增大压强平衡向正反应方向移动,则x=1;取曲线b、c,曲线b先出现拐点,T1、P2条件下反应速率比T2、P2条件下快,则T1![]() T2,T1、P2条件下平衡时C%比T2、P2条件下小,升高温度平衡向逆反应方向移动,逆反应为吸热反应,则正反应为放热反应;反应A(g)+B(g)
T2,T1、P2条件下平衡时C%比T2、P2条件下小,升高温度平衡向逆反应方向移动,逆反应为吸热反应,则正反应为放热反应;反应A(g)+B(g)![]() xC(g)的特点:正反应为气体分子数减小的放热反应。
xC(g)的特点:正反应为气体分子数减小的放热反应。
A项,升高温度平衡向逆反应方向移动,A的质量增大,Y轴不能表示A的质量;
B项,升高温度平衡向逆反应方向移动,B的百分含量增大,Y轴不能表示B的百分含量;
C项,升高温度平衡向逆反应方向移动,因为A、B、C都是气体,气体的总质量始终不变,容器的容积一定,混合气体的密度不变,Y轴不能表示混合气体密度;
D项,升高温度平衡向逆反应方向移动,气体分子物质的量增大,因为A、B、C都是气体,气体的总质量始终不变,混合气体的平均摩尔质量减小,P3![]() P4时,增大压强平衡向正反应方向移动,气体分子物质的量减小,因为A、B、C都是气体,气体的总质量始终不变,混合气体的平均摩尔质量增大,Y轴可表示混合气体的平均摩尔质量;
P4时,增大压强平衡向正反应方向移动,气体分子物质的量减小,因为A、B、C都是气体,气体的总质量始终不变,混合气体的平均摩尔质量增大,Y轴可表示混合气体的平均摩尔质量;
答案选D。


科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 一定条件下反应N2+3H2![]() 2NH3,达到平衡时,3v正(H2)=2v正(NH3)
2NH3,达到平衡时,3v正(H2)=2v正(NH3)
B. 10mL浓度为1mol/L的盐酸与过量的Zn粉反应,若加入适量的CH3COONa溶液,既能降低反应速率,又不影响H2的生成
C. 将pH=a+1的氨水稀释为pH=a的过程中,c(OH-)/c(NH3H2O)变小
D. 25℃时,0.1 mol/L的NaHB溶液呈酸性,说明H2B为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
A. 23gNa变为Na+时失去的电子数为0.2NA B. 18g水所含的电子数为NA
C. 8g He所含的分子数为NA D. 16g O2与16g O3所含的原子数均是NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知标准状况下气体摩尔体积为22.4L/mol,但很多化学实验并非在标准状况下进行,而是在常温常压下进行,下图为测定常温常压下气体摩尔体积的实验装置图。图中反应原理为:2C2H5OH+2Na→2C2H5ONa+H2↑(反应放热)。

(1)①该装置有明显错误处,请指出错误之处:_________;
②作图修改(只针对需修改部位):_____________。
(2)经过(1)改正后进行实验,实验过程如下:
a.检查装置气密性;
b.常温常压下,取4.6g乙醇与足量的金属钠反应并利用排水法收集产生的H2(假设广口瓶和量筒足够大);
c.当圆底烧瓶中不再有气泡产生,不能立即读数,必须先_____,后________,再平视读取量筒中收集到水的体积为1240.0mL。经计算常温常压下气体摩尔体积为__________。
(3)经过(1)改正后仍有实验误差,下列哪些选项会导致实验误差_______。
A.收集到的氢气中含有装置中原有的空气
B.收集H2前导管B中无蒸馏水
C.分液漏斗中的无水乙醇进入圆底烧瓶后占用了装置内气体空间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验室以一种工业上的废渣(废渣主要含有MgCO3、MgSiO3和少量Fe、Al的氧化物)为原料,制备MgCO3·3H2O。实验流程如下图所示:

(1)为了加快废渣的酸溶速率,可采取的办法有_________(任写一点),酸溶时废渣中主要成分发生反应的离子方程式为___________________________________。
(2)加入30%H2O2的目的是__________________________________。
(3)用萃取分液的方法除去溶液中的Fe3+
①加入30%H2O2后,检验溶液中是否含有Fe2+的最佳试剂是__________________________。
②萃取分液完成后,检验水相中是否含有Fe3+的最佳试剂是______________________________。
(4)室温下,除去MgSO4溶液中的A13+(使Al3+浓度小于1×10-6mol/L)而不引入其它杂质,应加入的试剂X为__________,应调节pH的范围为_________________。
已知:①Ksp[Al(OH)3]=1.0×10-33 ②pH=8.5时,Mg(OH)2开始沉淀
(5)向滤液中加入Na2CO3溶液生成MgCO3沉淀并用蒸馏水洗涤,确认沉淀洗净的操作及现象是____________________________。
(6)下图为不同反应温度下所得水合碳酸镁的X射线衍射谱图。由图可知,干燥时需控制温度范围为___________________,温度较高时MgCO3·3H2O发生转化的化学方程式为_______________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA,下列有关叙述不正确的是
A. 标准状况下,11.2LHF中含有氟原子的数目为0.5 NA
B. 含1molCl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+数为NA
C. 13g锌与一定量浓硫酸恰好完全反应,生成气体的分子数为0.2 NA
D. 28g乙烯和环丁烷的混合气体中含有的碳原子数为2 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com