
【题目】铜元素位于元素周期表中第ⅠB族,在化合物中其化合价可以呈现+1、+2 价。铜的单质及其化合物在很多领域有重要的应用。
Ⅰ.CuSO4和Cu(NO3)2是常见的+2价铜的化合物,有较为广泛的应用。
(1)向CuSO4溶液中滴加氨水,最后可以得到深蓝色的[Cu(NH3)4]SO4溶液。
①N、O、S三种元素的第一电离能由大到小的顺序为______________________________。
②比较NH3 和[Cu(NH3)4]2+中H-N-H键角的大小:NH3___________[Cu(NH3)4]2+(填“>”或“<”),并说明理由________________________。
(2)制备Cu(NO3)2的一种方法是在N2O4的乙酸乙酯溶液中加入铜,反应一段时间后,加热即可得到Cu(NO3)2。
①NO3- 的立体构型的名称为_______________,N原子的杂化方式为________________。NO3- 的一种等电子体为________________________。
②N2O4会发生类似于水的自偶电离N2O4![]() NO++NO3- ,制备无水Cu(NO3)2的化学方程式为__________________________________________。
NO++NO3- ,制备无水Cu(NO3)2的化学方程式为__________________________________________。
Ⅱ.CuCl是较为常见的+1价铜的化合物。
(3)基态Cu+ 的价层电子排布式为________________________。
(4)CuCl的晶胞结构如图所示,C1原子位于立方体的顶点和面心,Cu原子位于Cl原子构成的四面体体心。
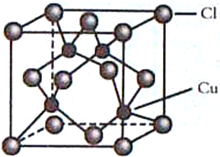
①每个Cl原子周围距Cl原子最近且等距离的Cu原子数目为________________。
②设NA为阿伏加德罗常数的值,晶体的密度为ρg/cm3,CuCl的摩尔质量为M g/mol,计算晶胞中距离最近的两个Cu原子间的距离为___________pm。
【答案】 N>O>S < 因为NH3 提供孤对电子与Cu2+ 形成配位键后,N-H成键电子对受到的排斥力减小,所以H-N-H键角增大 平面三角形 sp2杂化 CO32-、SO3 Cu+2N2O4![]() Cu(NO3)2+2NO↑ 3d10 4
Cu(NO3)2+2NO↑ 3d10 4 ![]()
【解析】(1)①非金属性越强,第一电离能越大,由于氮元素的2p轨道电子处于半充满状态,稳定性强,则N、O、S三种元素的第一电离能由大到小的顺序为N>O>S。②由于NH3提供孤对电子与Cu2+ 形成配位键后,N-H成键电子对受到的排斥力减小,所以H-N-H键角增大。(2)①NO3-中中心原子的价层电子对数是![]() ,因此硝酸根的立体构型的名称为平面三角形,N原子的杂化方式为sp2杂化。原子数和价电子数分别都相等的互为等电子体,则NO3-的一种等电子体为CO32-或SO3。②N2O4会发生类似于水的自偶电离N2O4
,因此硝酸根的立体构型的名称为平面三角形,N原子的杂化方式为sp2杂化。原子数和价电子数分别都相等的互为等电子体,则NO3-的一种等电子体为CO32-或SO3。②N2O4会发生类似于水的自偶电离N2O4![]() NO++NO3-,因此制备无水Cu(NO3)2的同时还有NO生成,反应的化学方程式为Cu+2N2O4
NO++NO3-,因此制备无水Cu(NO3)2的同时还有NO生成,反应的化学方程式为Cu+2N2O4![]() Cu(NO3)2+2NO↑。(3)铜的原子序数是29,基态Cu+的价层电子排布式为3d10。(4)①根据晶胞结构结合化学式可判断每个Cl原子周围距Cl原子最近且等距离的Cu原子数目为4个。②晶胞的边长是
Cu(NO3)2+2NO↑。(3)铜的原子序数是29,基态Cu+的价层电子排布式为3d10。(4)①根据晶胞结构结合化学式可判断每个Cl原子周围距Cl原子最近且等距离的Cu原子数目为4个。②晶胞的边长是![]() ,晶胞中距离最近的两个Cu原子间的距离为面对角线的一般,即为
,晶胞中距离最近的两个Cu原子间的距离为面对角线的一般,即为![]() 。
。


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 一定条件下反应N2+3H2![]() 2NH3,达到平衡时,3v正(H2)=2v正(NH3)
2NH3,达到平衡时,3v正(H2)=2v正(NH3)
B. 10mL浓度为1mol/L的盐酸与过量的Zn粉反应,若加入适量的CH3COONa溶液,既能降低反应速率,又不影响H2的生成
C. 将pH=a+1的氨水稀释为pH=a的过程中,c(OH-)/c(NH3H2O)变小
D. 25℃时,0.1 mol/L的NaHB溶液呈酸性,说明H2B为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验室以一种工业上的废渣(废渣主要含有MgCO3、MgSiO3和少量Fe、Al的氧化物)为原料,制备MgCO3·3H2O。实验流程如下图所示:

(1)为了加快废渣的酸溶速率,可采取的办法有_________(任写一点),酸溶时废渣中主要成分发生反应的离子方程式为___________________________________。
(2)加入30%H2O2的目的是__________________________________。
(3)用萃取分液的方法除去溶液中的Fe3+
①加入30%H2O2后,检验溶液中是否含有Fe2+的最佳试剂是__________________________。
②萃取分液完成后,检验水相中是否含有Fe3+的最佳试剂是______________________________。
(4)室温下,除去MgSO4溶液中的A13+(使Al3+浓度小于1×10-6mol/L)而不引入其它杂质,应加入的试剂X为__________,应调节pH的范围为_________________。
已知:①Ksp[Al(OH)3]=1.0×10-33 ②pH=8.5时,Mg(OH)2开始沉淀
(5)向滤液中加入Na2CO3溶液生成MgCO3沉淀并用蒸馏水洗涤,确认沉淀洗净的操作及现象是____________________________。
(6)下图为不同反应温度下所得水合碳酸镁的X射线衍射谱图。由图可知,干燥时需控制温度范围为___________________,温度较高时MgCO3·3H2O发生转化的化学方程式为_______________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是危害最为严重的大气污染物之一,SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理SO2。催化还原SO2不仅可以消除SO2污染,而且可得到有价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2 和H2O。已知CH4和S的燃烧热分别为890.3kJ/mol和297.2kJ/mol,CH4和SO2反应的热化学方程式为________________。
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
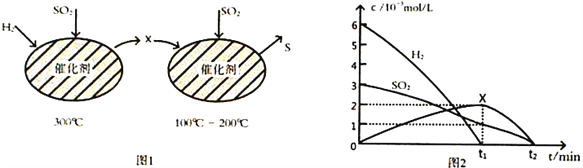
①分析可知X为____________(写化学式),0~t1时间段的温度为_________________,0~t1时间段用SO2 表示的化学反应速率为________________________________。
②总反应的化学方程式为_______________________________。
(3)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),恒容容器中,lmol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
S2(g)+2CO2(g),恒容容器中,lmol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
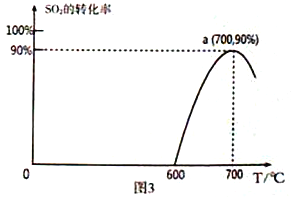
①该反应的ΔH_______________0 (填“>”或“<”)。
②计算a点的平衡常数为_______________________。
(4)工业上可用Na2SO3溶液吸收SO2,该反应的离子方程式为__________________________,25℃时用1mol/L的Na2SO3溶液吸收SO2,当溶液pH=7时,溶液中各离子浓度的大小关系为__________________。已知:H2SO3的电离常数K1=1.3×10-2,K2=6.2×10-8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、X、Y、Z的原子序数依次增大。R和X可形成两种液态化合物(常温常压),Y+和X2-具有相同的电子层结构,X和Z位于同一主族。下列说法正确的是
A. 原子半径大小顺序为:r(Y)>r(X)>r(Z)>r(R)
B. R与X形成的两种液态化合物中均只含极性共价键
C. Y与X可形成碱性氧化物Y2X2
D. 由R、X、Y、Z四种元素形成的常见化合物可抑制水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.0500 mol·L-1H2C2O4(二元弱酸)溶液滴定25.00 mL NaOH溶液所得滴定曲线如图。下列说法正确的是

A. 点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4—)= c(OH—)
B. 点②所示溶液中:c(HC2O4—)+2c(C2O42—)=0.0500mol·L-1
C. 点③所示溶液中:c(Na+)>c(HC2O4—)> c(H2C2O4) > c(C2O42—)
D. 滴定过程中可能出现:c(Na+)>c(C2O42—)=c(HC2O4—)>c(H+)>c(OH—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA,下列有关叙述不正确的是
A. 标准状况下,11.2LHF中含有氟原子的数目为0.5 NA
B. 含1molCl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+数为NA
C. 13g锌与一定量浓硫酸恰好完全反应,生成气体的分子数为0.2 NA
D. 28g乙烯和环丁烷的混合气体中含有的碳原子数为2 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com