
����Ŀ������������������Һ����pH=11�İ�ˮ����pH=11��NaOH��Һ����pH=3�Ĵ����pH=3�����ᣬ�����й�˵������ȷ����
A.�١����зֱ�����������Ȼ�茶��������Һ��pH����С
B.�ֱ��ˮϡ��10����������Һ��pH��>��>��>��
C.�١�������Һ��Ϻ�����Һ�����ԣ���������Һ��2c��NH4+��=c��SO42����
D.V1L����V2L����Һ��Ϻ�����Ϻ���ҺpH=4����V1��V2=11��9
���𰸡�C
��������
A����pH=11�İ�ˮ�����ڵ���ƽ�⣬�����Ȼ���ܽ��NH4����һˮ�ϰ��ĵ��������������ã�OH��Ũ�ȼ��٣�pH��С����pH=11��NaOH��Һ�����Ȼ�立�Ӧ�����Ȼ��ƺ�һˮ�ϰ�����Һ��OH��Ũ�ȼ��٣�pH��С��A����ȷ��
B���ֱ��ˮϡ��10������pH=11�İ�ˮ���ڵ���ƽ�⣬pH����С��1��Ӧ��10-11�䡢��pH=11��NaOH��Һ��ǿ�ϡ�ͺ�pHΪ10����pH=3�Ĵ�����Һ���ڵ���ƽ�⣬pH����С��1��Ӧ��3-4�䡢��pH=3��������ǿ�ᣬϡ�ͺ�pHΪ4����pH��СΪ�٣��ڣ��ܣ��ۣ�B����ȷ��
C���١�������Һ��Ϻ�����Һ�����ԣ�c(H+)= c(OH-)���ݻ����Һ�д��ڵĵ���غ�c(NH4+)+ c(H+)= c(OH-)+2 c(SO42-)���õ�c(NH4+)=2 c(SO42-)��C�����
D��V1L����V2L����Һ��Ϻ�����Ϻ���ҺpH=4�������Һ��c(H+)=10-4mol/L��˵����Һ�����ԣ������ӹ�����pH=3��������Һ��c(H+)=10-3mol/L��pH=11��NaOH��Һ��c(OH-)=10-3mol/L����ʽ���㣬![]() ��104������õ� V1��V2=11��9��D����ȷ��
��104������õ� V1��V2=11��9��D����ȷ��
��ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£��������������ƿ�ڷֱ�װ�д�����NH3����һ�������HCl����, NO2 ��O2�Ļ������[V(NO2)��V(O2) = 4��1 ]��Ȼ��ֱ�����Ȫʵ�飬������ƿ��������Һ�����ʵ���Ũ��֮��Ϊ
A. 2��1��2 B. 5��5��4 C. 1��1��1 D. ��ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ����
A.��״����2.24LCO2ͨ��1mol/L100mLNaOH��Һ�У�CO2+OH-��HCO3-
B.�������������������Fe(OH)3+3H+��Fe3++3H2O
C.Na2Sˮ�⣺S2-+2H2O![]() H2S+2OH-
H2S+2OH-
D.�����ʵ�����NH4HCO3��NaOH����Һ�з�Ӧ��NH4++HCO3-+2OH-��CO32-+NH3+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������Fe��FeO��Fe2O3��Fe3O4�Ļ�����м���150 mL 4 mol��L��1��ϡ����ǡ��ʹ�������ȫ�ܽ⣬�ų�2.24 L NO(��״��)����������Һ�м���KSCN��Һ����Ѫ��ɫ���֡�����������H2�ڼ��������»�ԭ��ͬ�����Ļ������õ����������ʵ���Ϊ(����)
A. 0.21 mol B. 0.25 mol C. 0.3 mol D. 0.35 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��֤±�ص��������Ե����ǿ����ijС������ͼ��ʾװ�ý���ʵ��(�г���������ȥ���������Ѽ���)��
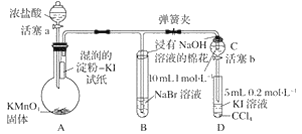
ʵ����̣�
��.���ɼУ�����a���μ�Ũ���ᡣ
��.��B��C�е���Һ����Ϊ��ɫʱ���н����ɼС�
��.��B����Һ�ɻ�ɫ��Ϊ�غ�ɫʱ���رջ���a��
��.����
��1����֤������������ǿ�ڵ��ʵ��������_________________________________________��
��2��B����Һ������Ӧ�����ӷ���ʽ��____________________________________________��
��3��Ϊ��֤���������ǿ�ڵ⣬�������IJ�����������________________________________��
��4��������ʵ���Ŀ����_________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����100��ʱ����0.100mol��N2O4�������1L����ܱ������У�������Ӧ��N2O4��g��2NO2�����ڸ�һ��ʱ��Ը������ڵ����ʽ��з������õ����±���
t/s c/��molL��1�� | 0 | 20 | 40 | 60 | 80 | 100 |
c��N2O4��/��molL��1�� | 0.100 | c1 | 0.050 | c3 | a | b |
c��NO2��/��molL��1�� | 0 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
�Իش��������⣺
��1���ﵽƽ��ʱN2O4��ת����Ϊ_____%������c2_____c3��a_____b��������ѡ�����������
��2��20 s��N2O4��Ũ��c1��_____mol/L��0��20s��N2O4��ƽ����Ӧ����Ϊ_____mol/(Ls)��
��3����������Ӧ�����Լ���ʼ�������ʵ������䣬����Ӧ���¶Ƚ��͵�80��ʱ���ﵽƽ��ʱNO2�����ʵ���Ϊ0.100 mol����ô����Ӧ��_____��Ӧ��ѡ�����Ȼ���ȣ�
��4��������ͬ��ʼ���������������������Ƕ����������壬Ҫ�ﵽ����ͬ����ƽ��״̬��������������ʼŨ��Ϊ_____mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ը�����(��Ҫ�ɷ�ΪFeO��Cr2O3������Al2O3��SiO2������)Ϊ��Ҫԭ����������ԭ�Ϻ췯��(��Ҫ�ɷ�Na2Cr2O7��2H2O)������Ҫ�����������£�
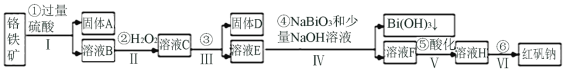
�������ϵ�֪��
���������£�NaBiO3������ˮ����ǿ�����ԣ��ڼ��������£��ܽ�Cr3+ת��Ϊ![]() ��
��
����
�������� | Fe3+ | Al3+ | Cr3+ | Fe2+ | Bi3+ |
��ʼ������pH | 2.7 | 3.4 | 5.0 | 7.5 | 0.7 |
������ȫ��pH | 3.7 | 4.9 | 5.9 | 9.7 | 4.5 |
�ش��������⣺
(1)Fe��Ԫ�����ڱ��е�λ��______________________________����Ӧ֮ǰ�Ƚ���ʯ�����Ŀ����__________________��
(2)����ۼӵ��Լ�Ϊ_____________����ʱ��ҺpHҪ����5��Ŀ��______________��
(3)д����Ӧ�ܵ����ӷ�Ӧ����ʽ______________________��
(4)�����ữ��ʹ![]() ת��Ϊ
ת��Ϊ![]() ��д���÷�Ӧ�����ӷ���ʽ_________________��
��д���÷�Ӧ�����ӷ���ʽ_________________��
(5)����ҺH��������Ũ������ȴ�ᾧ�����ˣ�ϴ�ӣ����T�ú췯�ƴ־��壬���ƺ췯����Դ־�����Ҫ���õIJ�����__________________(���������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1mol���ף�P4��s����4mol���ף�P��s����������Ӧ�����е������仯��ͼ��E��ʾ������������˵����ȷ���ǣ� ��
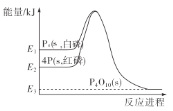
A. P4(s������)=4P(s������) ��H��0
B. ���ϱ仯�У����ͺ������������
C. ���ױȺ����ȶ�
D. ����ȼ�յ��Ȼ�ѧ����ʽ��4P(s������)��5O2(g)��P4O10(s) ��H=��(E2��E3)kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ת�������������������ԭ������(����)
A. NO2��HNO3��NO B. ![]() ��NH3
��NH3
C. NH3��NO D. P2O5��H3PO4
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com