
【题目】实现下列转化,必须加入氧化剂或还原剂的是( )
A. NO2→HNO3+NO B. ![]() →NH3
→NH3
C. NH3→NO D. P2O5→H3PO4
【答案】C
【解析】
在NO2→HNO3+NO的转化中,化合价变化的均是N元素,二氧化氮本身即是氧化剂又是还原剂;NH4+→NH3的转化中没有元素化合价的变化,属于非氧化还原反应;NH3→NO的转化中,氮元素化合价升高,NH3发生氧化反应;P2O5→H3PO4的转化中没有元素化合价的变化,属于非氧化还原反应。
在NO2→HNO3+NO的转化中,化合价变化的均是N元素,二氧化氮本身既是氧化剂又是还原剂,无需加入氧化剂或还原剂,故不选A;NH4+→NH3的转化中没有元素化合价的变化,属于非氧化还原反应,无需加入氧化剂或还原剂,故不选B;NH3→NO的转化中,氮元素化合价升高,NH3发生氧化反应,需加入氧化剂来实现,故选C;P2O5→H3PO4的转化中没有元素化合价的变化,属于非氧化还原反应,无需加入氧化剂或还原剂,故不选D。


科目:高中化学 来源: 题型:
【题目】有一含 NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。

(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是_________________。
②称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是______________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为______________________、_______________。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①如果实验中没有E装置,则会导致测量结果NaHCO3的质量________(填“偏大”、“偏小”或“无影响”)。
②若样品质量为w g,反应后C、D装置增加的质量分别为m1 g、m2 g,则混合物中Na2CO3·10H2O的质量分数为________(用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有HA、HB和H2C三种酸。室温下用0.1mol·L-1NaOH溶液分别滴定20.00 mL浓度均为0.1mol·L-1的HA、HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH 溶液体积的变化如图所示。
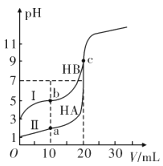
(1)a点时的溶液中由水电离出的c(H+)=________mol·L-1,Ka(HB)=________。
(2)与曲线I 上的c点对应的溶液中各离子浓度由大到小的顺序为________;b点对应的溶液中c(HB)____c(B-)(填“>”“<”或“=”)。
(3)已知常温下向0.1mol·L-1的NaHC 溶液中滴入几滴石蕊试液后溶液变成红色。
①若测得此溶液的pH=1,则NaHC的电离方程式为_______________。
②若在此溶液中能检测到H2C 分子,则此溶液中c(C2-)________c(H2C)(填“>”“<”或“=”)。
③若H2C的一级电离为H2C=H++ HC-,常温下0.1mol·L-1H2C溶液中的c(H+ )=0.11mol·L-1,则0.1mol·L-1NaHC溶液中的c(H+)________0.01mol·L-1(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,1mol N2和3mol H2混合后反应,达到平衡时测得混合气体的密度是同温同压下氢气的5倍,则氮气的转化率为( )
A. 20% B. 30% C. 40% D. 50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
|
|
|
|
根据以上规律判断,下列结论正确的是( )
A. 反应Ⅰ:ΔH>0,P2>P1 B. 反应Ⅱ:ΔH<0,T1<T2
C. 反应Ⅲ:ΔH>0,T2>T1;或ΔH<0,T2<T1 D. 反应Ⅳ:ΔH<0,T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体2.24L(标准状况),这些气体与一定体积O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4 mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是50 mL,下列说法正确的是 ( )
A. 混合气体中含NO21.12 L B. 消耗氧气的体积为1.68 L
C. 此反应过程中转移的电子为0.3 mol D. 参加反应的硝酸是0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性由强到弱的顺序为
A.a>b>c> dB.b>d>c>aC.c>a>b>dD.a>c>d>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酒后驾车是引发交通事故的重要原因。交警对驾驶员进行呼气酒精检测的原理是:橙色的K2Cr2O7酸性水溶液遇乙醇迅速生成蓝绿色Cr3+。下列对乙醇的描述与此测定原理有关的是
①乙醇沸点低②乙醇密度比水小③乙醇有还原性④乙醇是烃的含氧衍生物⑤乙醇有刺激性气味
A.①③B.②③C.②④⑤D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 氢氧燃料电池正极消耗22.4 L气体时,负极消耗的气体分子数目为2NA
B. 2.0gD2O中含有的质子数、电子数均为NA
C. 向含有FeI2的溶液中通入适量氯气,当有1molFe2+被氧化时,该反应转移电子数目一定为3NA
D. 14g分子式为CnH2n的烃中含有的共价键的数目一定为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com