
【题目】酒后驾车是引发交通事故的重要原因。交警对驾驶员进行呼气酒精检测的原理是:橙色的K2Cr2O7酸性水溶液遇乙醇迅速生成蓝绿色Cr3+。下列对乙醇的描述与此测定原理有关的是
①乙醇沸点低②乙醇密度比水小③乙醇有还原性④乙醇是烃的含氧衍生物⑤乙醇有刺激性气味
A.①③B.②③C.②④⑤D.①④
科目:高中化学 来源: 题型:
【题目】现有X、Y、Z、W、Q五种短周期元素,它们在周期表中的位置如下图所示。下列说法不正确的是
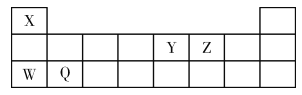
A. W的单质和某些化合物可用于道路照明、漂白剂、制玻璃等
B. 含W、Y、Z三种元素的化合物,其水溶液可能呈中性或碱性
C. X与Y、X与Z形成的简单化合物,分子间都能形成氢键,并且均具有氧化性和还原性
D. Y与Z形成的化合物只有五种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙实验小组设计如下实验装置分别制备SnCl4和漂白粉。
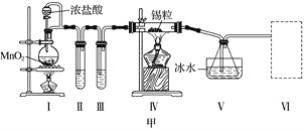
(1)已知:a.金属锡熔点231 ℃,化学活泼性与铁相似;
b.干燥的氯气与熔融金属锡反应生成SnCl4,SnCl4的沸点114 ℃;
c.SnCl2、SnCl4均易水解,易溶于有机溶剂,且Sn2+易被氧化。根据图甲装置回答:
①试管Ⅱ中的试剂是____________________,Ⅲ中的试剂是________________________。
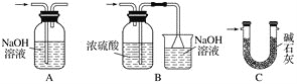
②Ⅵ处装置最好选用________(填字母)。
③Ⅰ处装置中反应的离子方程式是____________________________________________。
④实验结束后,欲回收利用装置Ⅰ中未反应完的MnO2,需要的玻璃仪器有______________。
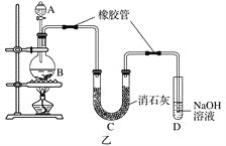
(2)已知:①Cl2与潮湿的消石灰反应是放热反应;②温度较高时Cl2与潮湿Ca(OH)2的反应为6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O。
根据图乙装置回答:此实验所得Ca(ClO)2产率较低的理由是
①________________________________________________________________________;
②________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的悬( )
A.化合物中的原子都是通过共价键相结合的
B.若化学反应吸收能量时,其断键吸收的能量大于成键放出的能量
C.化学反应中,断开化学键要放出能量,形成化学键要吸收能量
D.化学键是构成物质原子间的强相互作用,表现为原子核间的斥力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F( )为一种高分子树脂,其合成路线如下:
)为一种高分子树脂,其合成路线如下:

已知:①A为苯甲醛的同系物,分子中无甲基,其相对分子质量为134;
②
请回答下列问题:
(1)X的化学名称是_________________。
(2)E生成F的反应类型为_________________。
(3)D的结构简式为_________________。
(4)由B生成C的化学方程式为_________________。
(5)芳香族化合物Y是D的同系物,Y的同分异构体能与饱和Na2CO3溶液反应放出气体,分子中只有1个侧链,核磁共振氢普显示有5种不同化学环境的氢,峰值面积比为6:2:2:1:1。写出两种符合要求的Y的结构简式___________、__________。
(6)写出以甲醛、丙醛和乙二醇为主要原料合成软质隐形眼镜高分子材料—聚甲基丙烯酸羟乙酯( )的合成路线(无机试剂自选):_________________。
)的合成路线(无机试剂自选):_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO4-+5e-+8H+===Mn2++4H2O
(1)写出该氧化还原反应的离子方程式:_______________________。
(2)反应中氧化剂是________;被氧化元素是__________;若有0.5 mol H2O2参加此反应,电子转移个数为____________。
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为________________________;这时若有0.5 mol H2O2发生分解,电子转移个数为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设用NA表示阿伏加德罗常数的值,其计算近似值为6.02×1023,按要求完成下列填空:
(1)0.5 mol NH3共含有_______________个原子。
(2)6 mol H2O与标准状况下_____________L NH3所含氢原子数相等。
(3)某硫酸钠溶液中含有3.01×1023个Na+,则该溶液中SO42﹣的物质的量是_________________。
(4)标准状况下11.2 L NO和__________________g NO2所含有的氧原子数相等。
(5)8 g某物质含有3.01×1023个分子,该物质的相对分子质量约为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知几种酸的电离常数如下:K(CH3COOH)=1.8×10-5; K1(H2CO3)=4.4×10-7;K2(H2CO3)=4.7×10-11;K(HClO)=4.0×10-8。
I.(1)常温下,0.1mol·L-1的下列三种溶液:①CH3COONa溶液 ②Na2CO3溶液 ③NaClO溶液, 其pH由大到小的顺序是________________(填序号);
(2)往NaClO溶液中通入少量CO2的离子反应方程式为___________________________________;
II. 常温下,在25.00 mL 0.1000 mol·L-1Na2CO3溶液中滴加0.1000 mol·L-1盐酸,溶液的pH变化曲线如图所示。
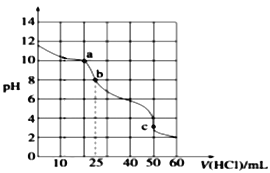
(3)a点溶液中c(CO32-) :c(HCO3-) =______________。
(4)b点溶液中溶质为______________。b点溶液呈碱性的原因为_______________________。
(5)b→c过程中的离子反应方程式为___________________________________________。
III. 现有某碳酸钠和氢氧化钠的混合溶液,为测定其中各成分的浓度,某实验小组设计了如下方案,步骤如下(结合上图回答下列问题):
①量取20.00mL样品溶液于锥形瓶中,加入几滴酚酞;
②用c mol·L-1的标准盐酸溶液滴定至终点;
③重复两次实验,消耗盐酸的体积平均值为V1 mL;
④另取20.00mL样品溶液于锥形瓶中,加入几滴甲基橙;
⑤用c mol·L-1的标准盐酸溶液滴定至终点;
⑥重复两次实验,消耗盐酸的体积平均值为V2 mL;
(6)步骤①中量取样品溶液所用仪器为___________________。
(7)步骤②终点现象为________________________________________________________________。
(8)样品溶液中碳酸钠和氢氧化钠物质的量浓度之比为___________。(用含c、V1、V2的式子表示),若步骤⑥中滴定结束时仰视读数,所得c(Na2CO3)_____(选填“偏大”、“偏小”、“不影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com