
【题目】强酸、强碱、大部分盐属于强电解质。下列属于弱电解质的是
A.HNO3B.Na2CO3C.NaOHD.CH3COOH
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,生成N2和水蒸气。已知:N2(g)+2O2(g)====N2O4(g) ΔH="+8.7" kJ·mol-1
N2H4(g)+O2(g) ====N2(g)+2H2O(g) ΔH="-534.0" kJ·mol-1
下列表示肼跟N2O4反应的热化学方程式,正确的是( )
A. 2N2H4(g)+N2O4(g) ====3N2(g)+4H2O(g)ΔH="-542.7" kJ·mol-1
B. 2N2H4(g)+N2O4(g) ====3N2(g)+4H2O(g)ΔH="-1" 059.3 kJ·mol-1
C. N2H4(g)+1/2 N2O4(g) ====3/2N2(g)+2H2O(g)ΔH="-1" 076.7 kJ·mol-1
D. 2N2H4(g)+N2O4(g) ====3N2(g)+4H2O(g)ΔH="-1" 076.7kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用FeS处理含Cu2+和Pb2+废水后的废弃固体(主要成分CuS、FeS、PbS、SiO2)制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:

(1)提高步骤①反应速率的措施,除温度外,还有_____________(写一条);
(2)处理废水时,FeS与Pb2+反应的离子方程式为____________;
(3)固体A的主要成分是_______________(填化学式);
(4)步骤⑤中,所加试剂x为____________(填标号);
a.Cl2 b.H2O2 c.KMnO4 d.HNO3
(5)检验溶液B完全转化为溶液C的试剂是_________________________;
(6)潮湿多雨的夏季,在细菌作用下,废石堆中的硫化铜与硫酸铁转化为含重金属盐的酸性废水(硫元素全部进入溶液中)而污染土壤。该转化反应的离子方程式为____________;
(7)已知,常温下FeS、CuS的Ksp分别为6.5x10-18和1.3x10-36)。现用过量的FeS处理含0.01mol·L-1 Cu2+的废水,处理后废水中c(Cu2+)=______mol·L-1(忽略体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应常用来焊接钢轨。下图为实验室进行铝热反应的装置,点燃镁条,反应过程中看到熔融物落入蒸发皿的沙子中。则下列有关说法中正确的是
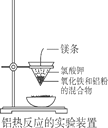
A. 金属氧化物与铝都能发生铝热反应
B. 该装置所用的漏斗是玻璃漏斗
C. 反应中观察到熔融物落入蒸发皿中,表明该反应是放热反应
D. 加氯酸钾的目的是用氯酸钾来氧化铝粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如图所示:

下列说法不正确的是
A. 酸溶过程使用的酸也可以是硝酸,且过量
B. 为了防止污染,焙烧过程中产生的SO2要回收利用
C. 通氯气的目的是氧化Fe2+
D. 由FeCl3·6H2O制取无水FeCl3需要在氯化氢的气流中加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示。下列说法错误的是

A. NO2是该过程的中间产物
B. NO和O2必须在催化剂表面才能反应
C. 汽车尾气的主要污染成分包括CO和NO
D. 催化转化总反应为2NO+O2+4CO![]() 4CO2+N2
4CO2+N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是( )

A. a和b都属于芳香族化合物
B. a和c分子中所有碳原子均处于同一平面上
C. a、b和c均能使酸性KMnO4溶液褪色
D. b和c均能与新制的Cu(OH)2反应生成红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乳酸(PLA),是一种无毒性、可再生、可分解的高分子聚合物塑料,PLA早期是开发在医学上使用,作手术缝合线及骨钉等,现在则已较广泛的应用于一些常见的物品,如:包装袋、纺织纤维,PLA由植物中萃取出淀粉(玉米、甜菜、小麦、甘薯等)或用纤维素(玉米干草、麦杆、甘蔗渣等木质的农业废弃物)经过下列过程制造而成:
淀粉或纤维素![]() 葡萄糖
葡萄糖![]() 乳酸
乳酸![]() 聚乳酸
聚乳酸
根据上述信息,回答下列问题:
(1)淀粉水解生成葡萄糖的化学方程式为_________;
(2)已知1mol葡萄糖![]() 2mol乳酸,转化过程中无其它反应物、生成物,则乳酸的分子式为_________;
2mol乳酸,转化过程中无其它反应物、生成物,则乳酸的分子式为_________;
(3)某研究性小组为了研究乳酸(无色液体,与水混溶)的性质,做了如下实验:
①取1.8g乳酸与过量的饱和NaHCO3溶液反应,测得生成的气体体积为448mL(气体体积已换算为标准状况下体积);
②另取1.8g乳酸与过量的金属钠反应,测得生成的气体体积为448mL(气体体积已换算为标准状况下体积)。
由实验数据推知乳酸分子含有_________(填官能团名称),从以上条件推知乳酸的结构简式可能为_________;
(4)经现代化学仪器分析,测定乳酸分子中含有一个甲基.请写出乳酸分子之间通过酯化反应生成的六元环状化合物的结构简式_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com