
【题目】科学家发现用二氧化钛(TiO2)作催化剂可以使水在光照条件下分解制得廉价的氢气,这使氢能源的研究和应用更向前迈进了一步。下列说法正确的是( )
A.使用二氧化钛作催化剂使水快速分解的同时放出大量热
B.催化剂的作用是通过改变反应的活化能来影响反应速率
C.该反应的原理是:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
D.每产生氢气44.8L,转移电子数目为4NA
科目:高中化学 来源: 题型:
【题目】化学基本概念是学习化学的基石,请正确回答下列问题。
(1)今有7种物质:①液态氯化氢 ②乙醇 ③熔融的KNO3 ④铜线 ⑤NaCl晶体 ⑥小苏打溶液 ⑦氨水。属于电解质的是___________,属于非电解质的是_____________。将①加入到⑦中,⑦的导电能力_______(填“增强”、“减弱”或“基本不变”)。
(2)漂白粉中加入盐酸,可产生氯气,化学方程式为:Ca(ClO)2+4HCl = CaCl2 +2Cl2+2H2O。用双线桥法表示该反应中电子转移的方向和数目_________,当有0.1 mol电子发生转移时,生成氯气的体积为_______L(标况下),被氧化的HCl为______mol。
(3)“四种基本反应类型与氧化还原反应的关系”如图所示:
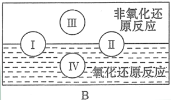
其中Ⅰ为化合反应,Ⅳ是_________反应。现有以下反应模型:单质A + 氧化物B=单质C + 氧化物D(A、B、C、D均为中学阶段常见物质,反应条件已略去),写出符合上述反应模型的化学反应方程式。
①若A为金属单质,B为非金属氧化物:_________________________。
②若A和C均为固体非金属单质:_______________________________。
(4)浓硫酸有强氧化性,常温下,向碳素钢(仅含铁、碳元素的合金)中加入少量浓硫酸,无明显现象,原因是:____________________,加热后,可能产生的气体有___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一处于平衡状态的可逆反应:X(s)+3Y(g)![]() 2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z
A.①③⑤B.②③⑤C.②③⑥D.②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2) = 5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3) = 3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是
A.溴水中存在如下平衡:Br2+H2O![]() HBr+HBrO,当加入NaOH溶液后颜色变浅
HBr+HBrO,当加入NaOH溶液后颜色变浅
B.合成氨反应:N2+3H2![]() 2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
C.反应:CO+NO2![]() CO2+NO ΔH<0,升高温度,平衡向逆反应方向移动
CO2+NO ΔH<0,升高温度,平衡向逆反应方向移动
D.对2H2O2![]() 2H2O+O2↑的反应,使用MnO2可加快制O2的反应速率
2H2O+O2↑的反应,使用MnO2可加快制O2的反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】瑞德西韦是一种核苷类似物,具有抗病毒活性,对新型冠状病毒病例展现出较好的疗效。其结构如图所示:

回答下列问题:
(1)该结构基态P原子中,核外电子占据最高能层的符号是________________,占据该能层电子的电子云轮廓图形状为________________。
(2)瑞德西韦中位于第二周期元素的第一电离能从大到小的顺序为________________,分子中氮原子的杂化类型有________________。
(3)苯酚(![]() )是合成瑞德西韦的原料之一,其熔点为43℃,苯酚的晶体类型是________________。苯酚与甲苯(
)是合成瑞德西韦的原料之一,其熔点为43℃,苯酚的晶体类型是________________。苯酚与甲苯(![]() )的相对分子质量相近,但苯酚的熔、沸点高于甲苯,原因是________________。
)的相对分子质量相近,但苯酚的熔、沸点高于甲苯,原因是________________。
(4)MgSO4是合成瑞德西韦的催化剂之一。MgSO4中,阴离子的空间构型为________________。
(5)磷酸也是合成瑞德西韦的原料之一。直链的多磷酸盐则是-种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示:
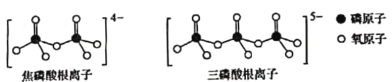
这类磷酸根离子的化学式可用通式表示为________________(用n代表P原子数)。
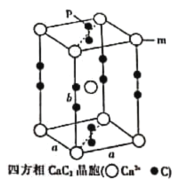
(6)合成瑞德西韦的原料之一的苯酚可通过如下途径制得:电石(CaC2)→乙烯→苯→溴苯→苯酚。四方相碳化钙(CaC2)晶体的晶跑结构如图所示.其晶胞参数分别为apm、apm、bpm,四方相碳化钙晶体的密度为![]() g·cm-3,[C≡C]2-中键长为cpm,阿伏加德罗常数的值为NA.则m位置的钙离子与P位置的碳原子之间的距离为________________pm(用不含a的计算表达式表示)。
g·cm-3,[C≡C]2-中键长为cpm,阿伏加德罗常数的值为NA.则m位置的钙离子与P位置的碳原子之间的距离为________________pm(用不含a的计算表达式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量A、B混合于2L的密闭容器中,发生如下反应:3A(g)+ B(g)![]() xC(g)+2D(g),经5min后达到平衡,测得D的浓度为0.5mol/L,c(A)︰c(B)=3︰5,C的平均反应速率是0.1mol/(L·min)
xC(g)+2D(g),经5min后达到平衡,测得D的浓度为0.5mol/L,c(A)︰c(B)=3︰5,C的平均反应速率是0.1mol/(L·min)
请计算:(写出计算过程,无过程不给分)
(1)平衡时A的浓度;______反应开始前容器中B的物质的量;_____
(2)前5 min内用B表示的平均反应速率;______
(3)化学反应方程式中x的值;_____
(4)5min时物质A的转化率。____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成。(提示:铝与氧化铁发生的反应称为铝热反应)
②另取20g A全部溶于0.15L 6.0mol·L-1盐酸中,得溶液C。
③将①中得到的单质B和溶液C反应,放出气体1.12L(标准状况下),同时生成溶液D,还残留固体B。
④用KSCN溶液检验时,溶液D不变色。
(1)反应①的产物中的单质B是________,反应方程为____________。若将单质B溶于盐酸中,再向所得溶液中滴加足量的NaOH溶液后振荡,可看到的现象为___________,此过程用化学方程可以表示为______________。
(2)②所发生各反应的离子方程式是:___________________和___________________。
(3)若溶液D的体积仍为0.15L,则该溶液中c(Mg2+)为________,c(Fe2+)为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有以下物质:①石墨;②氯化氢气体;③酒精;④氨水;⑤二氧化碳;⑥碳酸氢钠固体;⑦氯化铁溶液;⑧纯醋酸;⑨氧化钠固体;⑩铝。
(1)属于非电解质的是______________;属于强电解质的是__________;属于弱电解质的是___________。(用序号填空)
(2)写出物质⑥溶于水溶液显碱性的原因_______(用离子方程式和简要文字说明作答)
(3)写出物质⑥和⑧在水中反应的离子方程式:_____________。
(4)配制溶液⑦时通常将⑦先溶于___________,然后再加水稀释,通过增加溶液中_______的浓度以防止其发生水解。
(5)浓度、体积相同的②和⑧的溶液,加入相同形状且足量的Zn粒,反应速率快的是___(用序号填空);pH值、体积相同的②和⑧的溶液时,产生气体的量多的是________。(用序号填空)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com