
【题目】下列化合物中含有手性碳原子的是( )
A.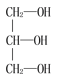 B.
B.![]() C.CCl2F2D.H2N-CH2-COOH
C.CCl2F2D.H2N-CH2-COOH
科目:高中化学 来源: 题型:
【题目】25℃时,在25mL 0.1mol·L-1的氢氧化钠溶液中,逐滴加入0.2mol·L-1 CH3COOH溶液,溶液的pH变化曲线如图所示,下列分析结论正确的是( )
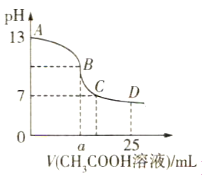
A.若B点的横坐标a=12.5,则有c(Na+)=c(CH3COO-)
B.对曲线上A、B间任意一点,溶液中都有c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C.D点时,c(CH3COO-)+c(CH3COOH)=c(Na+)
D.C点时,c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
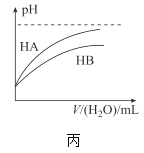
【题目】下列关于各图的叙述正确的是( )



A.甲表示![]() 与
与![]() 发生反应过程中的能量变化,则
发生反应过程中的能量变化,则![]() 的燃烧热为
的燃烧热为![]()
B.乙表示A、B两物质的溶解度随温度变化情况,将![]() 时A、B的饱和溶液分别升温至
时A、B的饱和溶液分别升温至![]() 时,溶质的质量分数
时,溶质的质量分数![]()
C.丙表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同浓度的NaA溶液的pH小于同浓度NaB溶液的pH
D.丁表示![]() 溶液滴定
溶液滴定![]() 醋酸溶液得到的滴定曲线
醋酸溶液得到的滴定曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.![]() 的名称为2-乙基丁烷
的名称为2-乙基丁烷
B.35Cl和37Cl 互为同素异形体
C.![]() 经催化加氢后能生成2-甲基戊烷
经催化加氢后能生成2-甲基戊烷
D.CH3CH2COOH和HCOOCH3互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某有机化合物A的结构,进行如下实验:
I. 分子式的确定:
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4g H2O和8.8g CO2,消耗氧气6.72L(标准状况下),则该物质的实验式是__________.

(2)用质谱仪测定该有机化合物的相对分子质量,得到如图①所示质谱图,则其相对分子质量为_______,该物质的分子式是_______.
(3)根据有机化合物的成键特点,预测A的可能结构并写出结构简式__________.
II.结构式的确定:
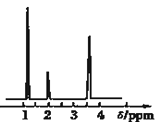
(4)核磁共振氢谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目.经测定,有机物A的核磁共振氢谱示意图如图②,则A的结构简式为_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠被用作肉制品发色剂、防腐剂等,硝酸钠在肉制品加工中作发色剂。但亚硝酸钠是食品添加剂中急性毒性较强的物质之一,是一种剧毒药,摄取少量亚硝酸盐进入血液后,可使正常的血红蛋白变成正铁血红蛋白而失去携带氧的功能,导致组织缺氧。硝酸钠的毒性作用主要是由于它在食物中、在水中或在胃肠道内被还原成亚硝酸盐所致。亚硝酸钠生产方法是由硝酸生产过程中的氮氧化物气体![]() 、
、![]() 用氢氧化钠或碳酸钠溶液吸收制得。硝酸钠的生产方法是将硝酸生产中的尾气用碱液吸收后,经硝酸转化,再用碱中和、蒸发、结晶、分离制得。
用氢氧化钠或碳酸钠溶液吸收制得。硝酸钠的生产方法是将硝酸生产中的尾气用碱液吸收后,经硝酸转化,再用碱中和、蒸发、结晶、分离制得。
![]() 实验室可用加热亚硝酸钠与氯化铵的浓溶液制取氮气,写出该反应的化学方程式:______ ;将亚硝酸钠溶液滴加到含淀粉的酸性KI溶液中,可观察到溶液变蓝色,写出该反应的离子方程式:______ ;将亚硝酸钠溶液滴加到
实验室可用加热亚硝酸钠与氯化铵的浓溶液制取氮气,写出该反应的化学方程式:______ ;将亚硝酸钠溶液滴加到含淀粉的酸性KI溶液中,可观察到溶液变蓝色,写出该反应的离子方程式:______ ;将亚硝酸钠溶液滴加到![]() 酸性溶液中,可观察到溶液的颜色由 ______ 色变为绿色,写出该反应的离子方程式:______ 。
酸性溶液中,可观察到溶液的颜色由 ______ 色变为绿色,写出该反应的离子方程式:______ 。
![]() 写出氮氧化物
写出氮氧化物![]() 、
、![]() 与氢氧化钠溶液反应生成亚硝酸钠溶液的离子方程式:______ ;若用
与氢氧化钠溶液反应生成亚硝酸钠溶液的离子方程式:______ ;若用![]() 溶液吸收
溶液吸收![]() 可生成
可生成![]() ,
,![]() 和
和![]() 溶液完全反应时转移电子
溶液完全反应时转移电子![]() ,则反应的离子方程式为 ______ 。
,则反应的离子方程式为 ______ 。
![]() 从下列试剂中选用部分试剂鉴别亚硝酸钠、硝酸钠和氯化钠三种无色溶液,它们是 ______ 。
从下列试剂中选用部分试剂鉴别亚硝酸钠、硝酸钠和氯化钠三种无色溶液,它们是 ______ 。
A.稀盐酸![]() 溶液
溶液![]() 稀硝酸
稀硝酸![]() 氢氧化钠溶液
氢氧化钠溶液
![]() 等物质的量浓度的亚硝酸钠、氯化钠、碳酸钠三种溶液中阴离子总浓度由大到小的顺序是 ______
等物质的量浓度的亚硝酸钠、氯化钠、碳酸钠三种溶液中阴离子总浓度由大到小的顺序是 ______ ![]() 填溶液中溶质的化学式
填溶液中溶质的化学式![]() 。
。
![]() 工业品硝酸钠含少量杂质
工业品硝酸钠含少量杂质![]() 、
、![]() 、NaCl、水不溶物
、NaCl、水不溶物![]() ,某同学欲测定工业品硝酸钠的纯度,进行了如下实验:
,某同学欲测定工业品硝酸钠的纯度,进行了如下实验:
![]() 称取
称取![]() 干燥工业品硝酸钠,投入盛适量蒸馏水的烧杯中,充分搅拌后加入10mL
干燥工业品硝酸钠,投入盛适量蒸馏水的烧杯中,充分搅拌后加入10mL![]() 的A溶液
的A溶液![]() 足量
足量![]() ,充分反应后过滤;
,充分反应后过滤;
![]() 向滤液中加入足量KI溶液和适量稀硫酸,充分反应后将所得溶液配成1000mL溶液;
向滤液中加入足量KI溶液和适量稀硫酸,充分反应后将所得溶液配成1000mL溶液;
![]() 取
取![]() 所配溶液于锥形瓶中,加入少量B物质,再用
所配溶液于锥形瓶中,加入少量B物质,再用![]() 的
的![]() 溶液滴定,用去
溶液滴定,用去![]() 溶液
溶液![]() 。
。
(有关反应为:![]()
![]() 溶液中的溶质的化学式是 ______ ,加入A溶液的作用是 ______ 。
溶液中的溶质的化学式是 ______ ,加入A溶液的作用是 ______ 。
![]() 物质是 ______ ,滴定终点时的颜色变化是 ______ 。
物质是 ______ ,滴定终点时的颜色变化是 ______ 。
![]() 若该同学操作正确,但结果造成测定结果略偏高,其原因可能是
若该同学操作正确,但结果造成测定结果略偏高,其原因可能是![]() 任写一点
任写一点![]() ______ 。
______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.C3H8中碳原子都采用的是sp3杂化
B.O2、CO2、N2都是非极性分子
C.酸性:H2CO3<H3PO4<H2SO4<HClO
D.CO的一种等电子体为NO+,它的电子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】推理是化学学习中常用的思维方法,下列推理合理的是
A. NaOH和CaCl2都是离子化合物,所以二者化学键类型相同
B. 可逆反应达平衡时,体系中各组分的浓度不再变化,可推知正、逆反应停止了
C. 原电池加快某些反应的速率,所以用锌与稀硫酸反应制取氢气常加入少量硫酸铜
D. 同条件下反应物浓度越大反应越快,所以铁在浓硝酸中比在稀硝酸中溶解得快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,相同pH的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH随加水体积变化的曲线如图所示。下列说法正确的是

A. HB的酸性强于HA
B. a点溶液的导电性大于b点溶液
C. 同浓度的NaA与NaB溶液中,c(A-)=c(B-)
D. 加水稀释到pH相同时,酸HA、HB用到的水V(A)小于V(B)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com