
����Ŀ����1L�����ܱ������г���X(g)��Y(g)��������ӦX(g)+Y(g)![]() M(g)+N(g)������ʵ���������±���
M(g)+N(g)������ʵ���������±���
ʵ���� | �¶�/�� | ��ʼʱ���ʵ���/mol | ƽ��ʱ���ʵ���/mol | |
n(X) | n(Y) | n(M) | ||
�� | 700 | 0.10 | 0.10 | 0.09 |
�� | 800 | 0.20 | 0.20 | 0.10 |
�� | 800 | 0.20 | 0. 30 | a |
�� | 900 | 0.10 | 0.15 | b |
����˵���������
A. ʵ����У���5minʱ���n(M) =0.05mol����0��5minʱ���ڣ���N��ʾ��ƽ����Ӧ����v(N) =0.01 mol/( L��min)
B. ʵ����У��÷�Ӧ��ƽ�ⳣ��K= 1.0
C. ʵ����У��ﵽƽ��ʱ��X��ת����Ϊ60%
D. ʵ����У��ﵽƽ��ʱ��b>0.06
���𰸡�D
��������A��v��N��=v��M��=![]() ����A��ȷ��
����A��ȷ��
B�� X��g��+Y��g��![]() M��g��+N��g��
M��g��+N��g��
��ʼŨ�ȣ�mol��L��1�� 0.01 0.04 0 0
ת��Ũ�ȣ�mol��L��1�� 0.008 0.008 0.008 0.008
ƽ��Ũ�ȣ�mol��L��1�� 0.002 0.032 0.008 0.008
ʵ����У��÷�Ӧ��ƽ�ⳣ��![]() ��B��ȷ��
��B��ȷ��
C�� X��g��+Y��g��![]() M��g��+N��g��
M��g��+N��g��
��ʼŨ�ȣ�mol��L��1�� 0.02 0.03 0 0
ת��Ũ�ȣ�mol��L��1�� 0.1a 0.1a 0.1a 0.1a
ƽ��Ũ�ȣ�mol��L��1��0.02-0.1a 0.03-0.1a 0.1a 0.1a
�÷�Ӧ��ƽ�ⳣ��K=![]() ���a=0.12��X��ת����=0.12/0.2��100%=60%����C��ȷ��D����������ʽ����ã�700��ʱ����ѧƽ�ⳣ��K��2.6�������¶���800���ƽ�ⳣ��ΪK=1.0��K��С����ƽ�������ƶ���������ӦΪ���ȷ�Ӧ�����ܵ��¶�Ϊ800�棬������ϵ�У������������ķ�Ӧ�������Ϊ��Чƽ�⣬b=1/2,a=0.06mol�����ܵ�ʵ���¶�Ϊ900�棬��Ƚ�800�棬ƽ�������ƶ���b��0.06����D����ѡD��
���a=0.12��X��ת����=0.12/0.2��100%=60%����C��ȷ��D����������ʽ����ã�700��ʱ����ѧƽ�ⳣ��K��2.6�������¶���800���ƽ�ⳣ��ΪK=1.0��K��С����ƽ�������ƶ���������ӦΪ���ȷ�Ӧ�����ܵ��¶�Ϊ800�棬������ϵ�У������������ķ�Ӧ�������Ϊ��Чƽ�⣬b=1/2,a=0.06mol�����ܵ�ʵ���¶�Ϊ900�棬��Ƚ�800�棬ƽ�������ƶ���b��0.06����D����ѡD��


 ���б�ˢ��ϵ�д�
���б�ˢ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ҩƷ��Ӧ���ٴ�Ӧ����ȷ����(����)
A. ��Ƽ��ʺ���ҽ�������������������������Ѫ��֢
B. ��Ʒ�����ж���ҩƷ
C. �ҹ�����ҽѧ����ʱ��������ҽѧ�����ǡ���ũ���ݾ���
D. ��Ƽ��ǹ��ʰ�ί���ϸ��ֹʹ�õ��˷ܼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ӿ�������Һ�д���������ǣ� ��
A.K+��Mg2+��SO42����OH��
B.Na+��H+��Cl����HCO3��
C.K+��Ag+��NO3����Cl��
D.K+��Cu2+��SO42����NO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ�������Ԫ�����Ͻ������½�Ԫ���������ƣ���Be��Al��B��Si��������������˵���������
A.BeO�����Ի�����B.Li2CO3��LiOH��������ˮ
C.1molBe��NaOH��Һ��Ӧ������1molH2D.��֪Si�۷е����B�۷е�Ҳ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������мȺ������Ӽ��ֺ��й��ۼ����ǵ���
A.HClB.KClC.H2SO4D.NH4NO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҽ�����������鷨�����Ƿ���˪( As2O3)�ж����漰�ķ�Ӧ���£�
I��6Zn+As2O3+12HCl=6ZnCl2+2AsH3�����飩��+3H2O
��2AsH3=2As����ɫ�龵��+3H2
��1��д����Ļ�̬ԭ�Ӽ۵����Ų�ͼ______________��
��2������Ŀռ�ṹΪ_______����������ԭ���ӻ���ʽΪ________��
��3������ͬ��ͬϵ����������������±���
NH3 | PH3 | AsH3 | SbH3 | |
�۵�/�� | -77.8 | -133.5 | -116.3 | -88 |
�е�/�� | -34.5 | -87.5 | -62.4 | -18.4 |
��PH3��AsH3��SbH3�۷е��������ߵ�ԭ����_________��NH3���������ԭ����_______��
��4����һ����������I(As)>I(Se)�����ܵ�ԭ����_____________��
��5��������(In)�γɵĻ�����(X)���������Ĺ�����ܣ��㷺Ӧ���ڹ���ͨ���ü��������侧���ṹ��ͼ��ʾ�����仯ѧʽΪ______�������߳�a= 666.67pm�������ܶ�Ϊ_____g/cm3���߳�a����![]() ���Ƽ��㣬��NA=6.0��1023/mol����
���Ƽ��㣬��NA=6.0��1023/mol����
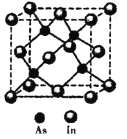
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ƣ�Na2S2O3��5H2O�����������մ��ֳ�Ϊ������������������ˮ���������Ҵ������ȡ�������ֽ⡣ijʵ����ģ�ҵ���ȡ��������ƣ��䷴Ӧװ�ü������Լ�����ͼ��
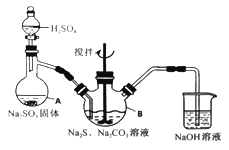
ʵ������������Ϊ��
�ٿ�����Һ©����ʹ�����������£��ʵ����ڷ�Һ�ĵ��٣�ʹ��Ӧ������SO2����Ͼ��ȵ�ͨ��Na2S��Na2CO3�Ļ����Һ�У�ͬʱ�����綯������������ˮԡ���ȣ��С�
��ֱ�������Ļ��Dz�����ʧ����������Һ��pH�ӽ�7ʱ��ֹͣͨ��SO2���塣
����
��1�������A������_______��
��2��Ϊ�˱�֤��������ƵIJ�����ʵ���в�������ҺpH <7���������ӷ���ʽ����ԭ��_________��
��3��д��������ƿB����ȡNa2S2O3����Ӧ���ܻ�ѧ��Ӧ����ʽ________��
��4����������������Һ�л�ýϸ߲���Na2S2O3��5H2O�IJ���Ϊ

Ϊ���ٲ�Ʒ����ʧ��������Ϊ���ȹ��ˣ�����������ԭ����______����������______���������dz��ˡ�ϴ�ӡ����
��5���ⶨ��Ʒ����
ȡ6.00g��Ʒ�����Ƴ�100mL��Һ��ȡ10.00mL��Һ���Ե�����ҺΪָʾ������Ũ��Ϊ0.500mol/LI2�ı���Һ���еζ�����Ӧԭ��Ϊ2S2O32-+I2=S4O62-+2I-��������ݼ�¼���±���ʾ��
��� | 1 | 2 | 3 |
��Һ�����/mL | 10.00 | 10.00 | 10.00 |
����I2����Һ�����/mL | 19.98 | 22.50 | 20.02 |
�ζ�ʱ���ﵽ�ζ��յ��������___________����Ʒ�Ĵ���Ϊ____________��
��6��Na2S2O3������������������Һ���ױ�Cl2������SO42-���÷�Ӧ�����ӷ���ʽΪ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(ClO2)�����ڷ�֯����ֽ��Ư�ס�ClO2���ڣ� ��
A.������B.��C.��D.��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ����H��ʾ��ȼ��ȼ���ȵ���
A. CO(g)��1/2O2(g)===CO2(g) ��H����283 kJ��mol��1
B. CH4(g)��2O2(g)===CO2(g)��2H2O(g) ��H����802.3 kJ��mol��1
C. 2H2(g)��O2(g)===2H2O(l) ��H����571.6 kJ��mol��1
D. H2(g)��Cl2(g)===2HCl(g) ��H����184.6 kJ��mol��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com