
我国工业上主要采用以下四种方法降低尾气中的含硫量:
| 方法1 | 燃煤中加入石灰石,将SO2转化为CaSO3,再氧化为CaSO4 |
| 方法2 | 用氨水将SO2转化为NH4HSO3,再氧化为(NH4)2SO4 |
| 方法3 | 高温下用水煤气将SO2还原为S |
| 方法4 | 用Na2SO3溶液吸收SO2,再电解转化为H2SO4 |
(1)2CaCO3(S)+2SO2(g)+O2(g)=2CaSO4(S)+2CO2(g) ΔH=-2762.2 kJ/mol;K=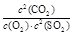 ;
;
(2)使生成的SO2完全逸出,防止SO2被氧化造成误差;洗涤;干燥; 95%;
(3)还原气体过量可以提高SO2的转化率;
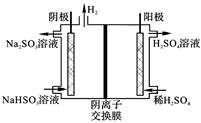
(4)SO32-+H2O-2e-=2H++SO42-;
解析试题分析:(1)③+②×2-①×2.整理得2CaCO3(S)+2SO2(g)+O2(g)=2CaSO4(S)+2CO2(g) ΔH=-2762.2 kJ/mol。此反应的平衡常数表达式为K=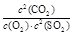 ;(2)向溶液中加入植物油形成油膜,用滴管插入液面下加入过量盐酸,充分反应,再加热煮沸目的是使生成的SO2完全逸出,防止SO2被氧化造成误差步骤④两步实验操作分别是洗涤、干燥;n(BaSO4)=n( (NH4)2SO4)=m/M=23.3g÷233g/mol=0.1mol,m((NH4)2SO4)=n·M=0.1mol×132g/mol=13.2g.所以样品中(NH4)2SO4的质量分数(13.2g÷13.9 g) ×100%= 95%.(3)高温下用水煤气将SO2还原为S的方程式为CO(g)+H2(g)+SO2(g)
;(2)向溶液中加入植物油形成油膜,用滴管插入液面下加入过量盐酸,充分反应,再加热煮沸目的是使生成的SO2完全逸出,防止SO2被氧化造成误差步骤④两步实验操作分别是洗涤、干燥;n(BaSO4)=n( (NH4)2SO4)=m/M=23.3g÷233g/mol=0.1mol,m((NH4)2SO4)=n·M=0.1mol×132g/mol=13.2g.所以样品中(NH4)2SO4的质量分数(13.2g÷13.9 g) ×100%= 95%.(3)高温下用水煤气将SO2还原为S的方程式为CO(g)+H2(g)+SO2(g) S(s)+ CO2(g)+ H2O(g)。由方程式可知反应时它们的物质的量的比为1:1:1.保持气配比为0.75即还原气体过量,目的是可以提高SO2的转化率,使更多的SO2还原为S单质,从而大大降低尾气中的含硫量。(4)用惰性电极电解Na2SO3溶液,阳极电极反应方程式为SO32-+H2O-2e-=2H++SO42-;阴极的电极反应式为2 HSO3-+2e-= H2↑+2SO32-。
S(s)+ CO2(g)+ H2O(g)。由方程式可知反应时它们的物质的量的比为1:1:1.保持气配比为0.75即还原气体过量,目的是可以提高SO2的转化率,使更多的SO2还原为S单质,从而大大降低尾气中的含硫量。(4)用惰性电极电解Na2SO3溶液,阳极电极反应方程式为SO32-+H2O-2e-=2H++SO42-;阴极的电极反应式为2 HSO3-+2e-= H2↑+2SO32-。
考点:考查降低尾气中的含硫量的四种方法的化学反应原理的知识。


科目:高中化学 来源: 题型:填空题
能源的开发利用与人类社会的可持续发展息息相关。
Ⅰ.已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)
ΔH1=a kJ·mol-1
CO(g)+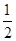 O2(g)=CO2(g) ΔH2=b kJ·mol-1
O2(g)=CO2(g) ΔH2=b kJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH3=c kJ·mol-1
则C的燃烧热ΔH=________ kJ·mol-1。
Ⅱ.(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是________(填序号)。
A.C(s)+CO2(g)=2CO(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
C.2H2O(l)=2H2(g)+O2(g)
D.2CO(g)+O2(g)=2CO2(g)
若以熔融的K2CO3与CO2为反应的环境,依据所选反应设计成一个原电池,请写出该原电池的负极反应:____________________________________________________________。
(2)某实验小组模拟工业合成氨反应N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为p0,反应过程中压强用p表示,反应过程中
2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为p0,反应过程中压强用p表示,反应过程中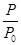 与时间t的关系如图所示。
与时间t的关系如图所示。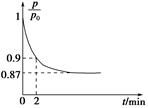
请回答下列问题:
①反应达平衡的标志是(填字母代号)________。
A.压强保持不变
B.气体密度保持不变
C.NH3的生成速率是N2的生成速率的2倍
②0~2 min内,以c(N2)变化表示的平均反应速率为________。
③欲提高N2的转化率,可采取的措施有________。
A.向体系中按体积比1∶1再充入N2和H2
B.分离出NH3
C.升高温度
D.充入氦气使压强增大
E.加入一定量的N2
(3)25 ℃时,BaCO3和BaSO4的溶度积常数分别是8×10-9和1×10-10,某含有BaCO3沉淀的悬浊液中,c(CO32-)=0.2 mol·L-1,如果加入等体积的Na2SO4溶液,若要产生BaSO4沉淀,加入Na2SO4溶液的物质的量浓度最小是________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲醇是一种重要的可再生能源,工业上可用CO和H2合成。
(1)已知:CO(g)+1/2O2(g)=CO2(g) △H=—283 kJ·mol—1
CH3OH(l)+3/2O2(g)=CO2(g) +2H2O(l) △H=—725kJ·mol—1
若要求得CO(g)+2H2(g)=CH3OH(l)的△H,还需要知道反应(用化学方程式表示) 的焓变。
(2)在Cu2O/ZnO做催化剂的条件下,将CO(g)和H2(g)充入容积为2L的密闭容器中合成CH3OH(g),反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图。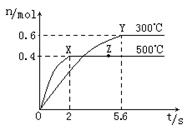
根据题意回答下列问题:
①反应达到平衡时,平衡常数表达式K= ;
升高温度,K值 (填“增大”、“减小”
或“不变”)。
②在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)= 。
③若其它条件不变,对处于Z点的体系,将体积压缩至原来的1/2,达到新的平衡后,下列有关该体系的说法正确的是 。
a.氢气的浓度与原平衡比减少 b.正、逆反应速率都加快
c.甲醇的物质的量增加 d.重新平衡时n(H2) /n(CH3OH)增大
④据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2有利于维持Cu2O的量不变,原因是: (写出相关的化学方程式并辅以必要的文字说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
研究化学反应中的能量变化有重要意义。请根据学过知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如下图所示: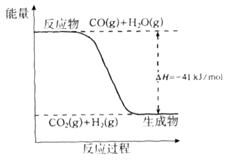
①反应的热化学方程式为____________________________________________。
②已知: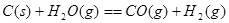
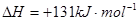
则
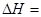
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0 kJ·mol-1; N-H键的键能是391.55 kJ·mol-1。则1/2N2(g) + 3/2H2(g) ="=" NH3(g) ΔH = 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
能源的开发、利用与人类社会的可持续发展息息相关,充分利用好能源是摆在人类面前的重大课题。
Ⅰ.已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH=a kJ·mol-1
②CO(g)+l/2O2(g)=CO2(g) ΔH=b kJ·mol-1
③C(石墨)+O2(g)=CO2(g) ΔH=c kJ·mol-1
则反应4Fe(s)+3O2(g)=2Fe2O3(s)的焓变ΔH= kJ·mol-1。
Ⅱ.依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是 (填序号)。
A.C(s)+CO2(g)=2CO(g) ΔH>0 B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH<0
C.2H2O(l)=2H2(g)+O2(g) ΔH>0 D.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH<0
若以稀硫酸为电解质溶液,则该原电池的正极反应式为 。
Ⅲ.氢气作为一种绿色能源,对于人类的生存与发展具有十分重要的意义。
(1)实验测得,在通常情况下,1 g H2完全燃烧生成液态水,放出142.9 kJ热量。则H2燃烧的热化学方程式为 。
(2)用氢气合成氨的热化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
①一定条件下,下列叙述可以说明该反应已达平衡状态的是 。
A.υ正(N2)=υ逆(NH3)
B.各物质的物质的量相等
C.混合气体的物质的量不再变化
D.混合气体的密度不再变化
②下图表示合成氨反应达到平衡后,每次只改变温度、压强、催化剂中的某一条件,反应速率υ与时间t的关系。其中表示平衡混合物中的NH3的含量最高的一段时间是 。图中t3时改变的条件可能是 。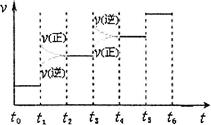
③温度为T℃时,将4a mol H2和2a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50%,则反应的平衡常数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
按要求写出下列方程
(1)碳酸钠溶液呈碱性的原因,用离子方程表示 。
(2)用锌保护海底钢铁设施,其中负极发生的电极反应为: 。
(3)含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则表示该反应中和热的热化学方程式 。
(4)氢氧化镁溶解在浓的氯化铵溶液,用离子方程表示 。
(5) Al(OH)3的电离反应方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)已知反应及几种物质中化学键断裂时的能量变化如下所示:
H2(g)+Cl2(g)=2HCl(g) △H=-184kJ/mol
4HCl (g)+O2(g)=2Cl2 (g) +2H2O (g) △H=-115.6kJ/mol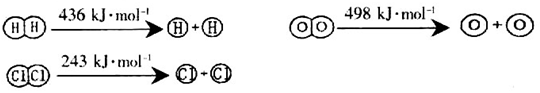
①H2与O2反应生成气态水的热化学方程式为_________________________________;
②断开1mol H—O键所需能量约为_________________________kJ。
(2)已知某反应的平衡常数表达式为:K= ,它所对应的化学方程式为________________。
,它所对应的化学方程式为________________。
(3)已知反应N2(g)+3H2(g) 2NH3(g) △H<0在400℃时K=0.5,此条件下在0.5L的密闭容器中进行该反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应υ(N2)正______υ(N2)逆(填“>”、“<”或“=”)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的措施是_______(填序号)。
2NH3(g) △H<0在400℃时K=0.5,此条件下在0.5L的密闭容器中进行该反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应υ(N2)正______υ(N2)逆(填“>”、“<”或“=”)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的措施是_______(填序号)。
A.缩小体积增大压强 B.升高温度
C.加催化剂 D.使氨气液化移走
(4)在一定体积的密闭容器中进行如下化学反应:A(g)+3B(g) 2C(g)+D(s) △H,其化学平衡常数K与T的关系如下表:
2C(g)+D(s) △H,其化学平衡常数K与T的关系如下表:
| T/K | 300 | 400 | 500 | …… |
| K/(mol·L-1)2 | 4×106 | 8×107 | 1.2×109 | …… |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮可形成多种氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构式分别是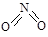 和
和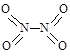 。实验测得N-N键键能为167kJ·mol-1, NO2中氮氧键的平均键能为466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能为167kJ·mol-1, NO2中氮氧键的平均键能为466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
(1)写出N2O4转化为NO2的热化学方程式:
(2)对反应N2O4(g) 2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 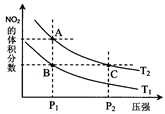
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.40mol的NO2气体充入2 L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.050 | n2 | 0.080 | 0.080 |
 N2O4的平衡常数K将 (填“增大”、“减小”或“不变”)。
N2O4的平衡常数K将 (填“增大”、“减小”或“不变”)。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
二甲醚(CH3OCH3,沸点为-24.9℃)被称为21世纪的新型能源。科学家利用太阳能分解水生成的氢气与从烟道气中分离出的CO2在催化剂作用下合成二甲醚,并开发出直接以二甲醚为燃料的燃料电池。其合成流程如下:
(1)已知:CH3OCH3(g)、H2(g)的标准燃烧热分别为:△H= -1455.0kJ·mol-1、△H=" -285.8" kJ·mol-1。写出以CO2、H2合成CH3OCH3的热化学方程式: ;
(2)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂。写出吸收CO2反应的化学方程式 ;
(3)一定条件下用CO2和H2合成二甲醚,反应物气流量对CO2的转化率、二甲醚的选择性(是指转化生成二甲醚的碳占已转化碳的比例)影响结果如图1所示,当控制气流量为28mL· min-1时,则生成0.3mol二甲醚需要通入CO2的物质的量为 ;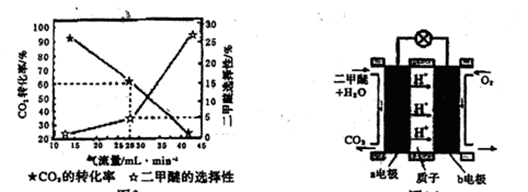
图1 图2
(4)图2为二甲醚燃料电池示意图。
①a电极的电极反应式为 ;
②若以1.12 L·min-l(标准状况)的速率向该电池中通入二甲醚,用该电池电解50mL2 mol·L-1 CuSO4溶液,通电0.50 min后,计算理论上可析出金属铜的质量为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com