
�о���ѧ��Ӧ�е������仯����Ҫ���塣�����ѧ��֪ʶ�ش��������⣺
��1����֪һ����̼��ˮ������Ӧ���̵������仯����ͼ��ʾ��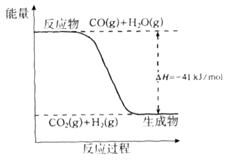
�ٷ�Ӧ���Ȼ�ѧ����ʽΪ____________________________________________��
����֪��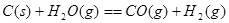
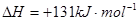
��
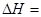
��2����ѧ��Ӧ����Ϊ�ɼ����Ѻ��¼��γɵĹ��̡���ѧ���ļ������γɣ����1 mol��ѧ��ʱ�ͷţ������գ�����������֪��N��N���ļ�����948.9kJ��mol��1��H��H���ļ�����436.0 kJ��mol��1�� N��H���ļ�����391.55 kJ��mol��1����1/2N2(g) + 3/2H2(g) ="=" NH3(g) ��H = ��
��1����CO(g)+H2O(g)=CO2(g)+H2(g) ��H=��41KJ/mol�� �ڡ�H=+172KJ/mol��
��2����46.2 KJ/moL
���������������1���������仯ͼʾ��֪�÷�Ӧ���Ȼ�ѧ����ʽΪ����CO(g)+H2O(g)=CO2(g)+H2(g) ��H=��41KJ/mol���ڽ�CO(g)+H2O(g)=CO2(g)+H2(g)��ȥC(s)+H2O(g)=CO(g)+H2(g)�������ɵã�C(s)+CO2(g)-2CO(g) ��H=+172KJ/mol����2�����ݼ��ܵĶ��弰�뷴Ӧ�ȵĹ�ϵ��֪�� ��H="1/2��948.9kJ/mol+3/2��436.0" kJ/mol-3��391.55kJ/mol="��46.2" KJ/moL
���㣺�����Ȼ�ѧ����ʽ����д����˹���ɵ�Ӧ�ü���Ӧ���뻯ѧ���ļ��ܵĹ�ϵ��֪ʶ��


 Ӯ�ڿ�����ʦ��ʱ�ƻ�ϵ�д�
Ӯ�ڿ�����ʦ��ʱ�ƻ�ϵ�д� �������Ͽ�ʱͬ��ѵ��ϵ�д�
�������Ͽ�ʱͬ��ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���º���������,����Է�������ת��,�䷴Ӧ���̺�������ϵ��ͼ1��ʾ����֪:2SO2(g)+O2(g) 2SO3(g)��
2SO3(g)��
��H="-196.6" kJ/mol��
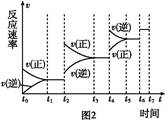
��ش���������:
(1)д���ܱ�ʾ���ȼ���ȵ��Ȼ�ѧ����ʽ: ��
(2)��H2=����������������������
(3)���º���ʱ,1 mol SO2��2 mol O2��ַ�Ӧ,�ų���������ֵ�ȨO��H2�O��������(�����С������ȡ�)��
(4)�����еĻ������ͨ��������NaOH��Һ������NaOH�����ʵ���Ϊ��������,����Һ�з�����������ԭ��Ӧ,��ù��̵����ӷ���ʽΪ�� ��
(5)����������,���д�ʩ����ʹn(SO3)/ n(SO2)�����������������
a.�����¶�
b.����He��
c.�ٳ���1 mol SO2(g)��1 mol O2(g)
d.ʹ�ô���
(6)ijSO2(g)��O2 (g)��ϵ,ʱ��t1�ﵽƽ���,�ı�ijһ�������,��Ӧ����v��ʱ��t�Ĺ�ϵ��ͼ2��ʾ,�����ı�SO2(g)��O2 (g)����,��ͼ��t4ʱ����ƽ���ƶ���������������������;ͼ�б�ʾƽ��������SO3�ĺ�����ߵ�һ��ʱ��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(1)(�㶫)����ʯ[��Ҫ�ɷ�Ca5(PO4)3F]�ڸ������Ʊ�����(P4)���Ȼ�ѧ����ʽΪ��4Ca5(PO4)3F(s)��21SiO2(s)��30C(s)===3P4(g)��20CaSiO3(s)��30CO(g)��SiF4(g)����H
��������Ӧ�У����������������________��
����֪��ͬ�����£�
4Ca5(PO4)3F(s)��3SiO2(s)===6Ca3(PO4)2(s)��2CaSiO3(s)��SiF4(g)����H1
2Ca3(PO4)2(s)��10C(s)===P4(g)��6CaO(s)��10CO(g)����H2
SiO2(s)��CaO(s)===CaSiO3(s)����H3
�æ�H1����H2�ͦ�H3��ʾ��H����H��____________��
(2)(����)��H2O2��H2SO4�Ļ����Һ���ܳ�ӡˢ��·�������ĩ�е�ͭ����֪��
��Cu(s)��2H��(aq)===Cu2��(aq)��H2(g) ��H1����64.39 kJ��mol��1
��2H2O2(l)===2H2O(l)��O2(g) ��H2����196.46 kJ��mol��1
��H2(g)��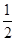 O2(g)===H2O(l) ��H3����285.84 kJ��mol��1
O2(g)===H2O(l) ��H3����285.84 kJ��mol��1
��H2SO4��Һ�У�Cu��H2O2��Ӧ����Cu2����H2O���Ȼ�ѧ����ʽΪ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��֪��Ӧ��Fe(s)+CO2(g) FeO(s)+CO(g)����H="a" kJ��mol-1,ƽ�ⳣ��ΪK;��Ӧ��CO(g)+1/2O2(g)
FeO(s)+CO(g)����H="a" kJ��mol-1,ƽ�ⳣ��ΪK;��Ӧ��CO(g)+1/2O2(g) CO2(g)����H="b" kJ��mol-1;��Ӧ��Fe2O3(s)+3CO(g)
CO2(g)����H="b" kJ��mol-1;��Ӧ��Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)����H="c" kJ��mol-1������ڲ�ͬ�¶���,Kֵ����:
2Fe(s)+3CO2(g)����H="c" kJ��mol-1������ڲ�ͬ�¶���,Kֵ����:
| �¶�/�� | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
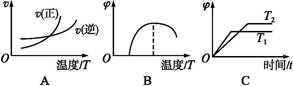
 2FeO(s)�Ħ�H=����������
2FeO(s)�Ħ�H=���������� �鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����ѣ�DME������Ϊ��21���͵����ȼ�ϡ����ɺϳ����Ʊ������ѵ���Ҫԭ�����£�
�� CO(g)+2H2(g)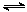 CH3OH(g) ��H 1=��90.7 kJ��mol-1
CH3OH(g) ��H 1=��90.7 kJ��mol-1
�� 2CH3OH(g)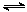 CH3OCH3(g)+H2O(g) ��H 2=��23.5 kJ��mol-1
CH3OCH3(g)+H2O(g) ��H 2=��23.5 kJ��mol-1
�� CO(g)+H2O(g)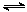 CO2(g)+H2(g) ��H 3=��41.2kJ��mol-1
CO2(g)+H2(g) ��H 3=��41.2kJ��mol-1
�ش��������⣺
��1����Ӧ3H2(g)��3CO(g)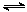 CH3OCH3(g)��CO2(g)�ġ�H�� kJ��mol-1��
CH3OCH3(g)��CO2(g)�ġ�H�� kJ��mol-1��
��2�����д�ʩ�У������CH3OCH3���ʵ��� ��
A��ʹ�ù�����CO B�������¶� C������ѹǿ
��3����Ӧ�������CH3OCH3�IJ��ʣ�ԭ���� ��
��4�����ϳ�����n(H2)/n(CO)=2ͨ��1 L�ķ�Ӧ���У�һ�������·�����Ӧ��
4H2(g)+2CO(g) 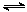 CH3OCH3(g)+H2O(g) ��H����CO��ƽ��ת�������¶ȡ�ѹǿ�仯��ϵ��ͼ1��ʾ������˵����ȷ���� ��
CH3OCH3(g)+H2O(g) ��H����CO��ƽ��ת�������¶ȡ�ѹǿ�仯��ϵ��ͼ1��ʾ������˵����ȷ���� ��
A����H <0
B��P1<P2<P3
C������P3��316��ʱ����ʼʱn(H2)/n(CO)=3����ﵽƽ��ʱ��COת����С��50��[
��5������һ�����͵Ĵ�������Ҫ�ɷ���Cu-Mn�ĺϽ𣩣�����CO��H2�Ʊ������ѡ��۲�ͼ2�ش����⡣������n(Mn)/n(Cu)ԼΪ ʱ�������ڶ����ѵĺϳɡ�
��6��ͼ3Ϊ��ɫ��Դ��������ȼ�ϵ�ء��Ĺ���ԭ��ʾ��ͼ��a�缫�ĵ缫��ӦʽΪ ��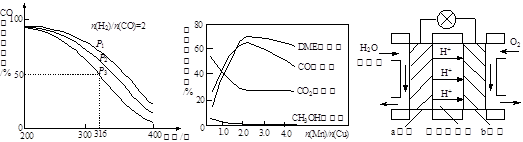
ͼ1 ͼ2 ͼ3
��7���״�Һ����ˮ���ƶ����ѵ�ԭ���ǣ�CH3OH +H2SO4��CH3HSO4+H2O��
CH3 HSO4+CH3OH��CH3OCH3+H2SO4����ϳ����Ʊ������ѱȽϣ��ù��յ��ŵ��Ƿ�Ӧ�¶ȵͣ�ת���ʸߣ���ȱ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
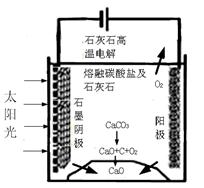
��15�֣���Դ�����ö�����̼�����ɼ�������������ŷţ��������»��ȼ�ϻ���Ҫ��ҵ��Ʒ��
��1����CO2��NH3Ϊԭ�Ͽɺϳɻ�������[CO(NH2)2]����֪��
��2NH3��g���� CO2��g���� NH2CO2NH4��s�� ��H �� -159.47 kJ��mol-1
��NH2CO2NH4��s���� CO(NH2)2��s���� H2O��g�� ��H �� +116.49 kJ��mol-1
��H2O��l���� H2O��g�� ��H ��+88.0 kJ��mol-1
��д��NH3��CO2�ϳ����غ�Һ̬ˮ���Ȼ�ѧ����ʽ ��
��2����һ�������£�������̼ת��Ϊ����ķ�Ӧ���£�
CO2(g)+4H2(g) CH4(g)+2H2O(g) ��H��0
CH4(g)+2H2O(g) ��H��0
����һ�ݻ�Ϊ2L�ĺ����ܱ������г���һ������CO2��H2����300��ʱ����������Ӧ���ﵽƽ��ʱ�����ʵ�Ũ�ȷֱ�ΪCO2��0.2mol��L��1��H2��0.8mol��L��1��CH4��0.8mol��L��1��H2O��1.6mol��L��1����ʼ����CO2��H2�����ʵ����ֱ�Ϊ �� ��CO2��ƽ��ת����Ϊ ��
������������ͬ�ĺ��ݾ��ȣ������û�������������ܱ�����I��II����I�г���1 molCO2,��4 molH2����II�г���1 mol CH4��2 mol H2 O(g) ��300���¿�ʼ��Ӧ���ﵽƽ��ʱ������˵����ȷ���� ������ĸ����
| A������I��II������Ӧ������ͬ |
| B������I��II��CH4�����ʵ���������ͬ |
| C������I��CO2�����ʵ���������II�еĶ� |
| D������I��CO2��ת����������II��CH4��ת����֮��С��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
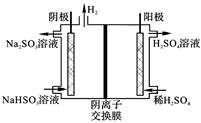
�ҹ���ҵ����Ҫ�����������ַ�������β���еĺ�������
| ����1 | ȼú�м���ʯ��ʯ����SO2ת��ΪCaSO3��������ΪCaSO4 |
| ����2 | �ð�ˮ��SO2ת��ΪNH4HSO3��������Ϊ(NH4)2SO4 |
| ����3 | ��������ˮú����SO2��ԭΪS |
| ����4 | ��Na2SO3��Һ����SO2���ٵ��ת��ΪH2SO4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
����β����NOx�����������������������㷺��ע��
��1��ij��ȤС����������������Ϣ��
N2(g)+O2(g)=2NO(g) ��H=+180.5kJ/mol
2H2(g)+O2(g)=2H2O(g)) ��H=�D483.6kJ/mol
��Ӧ2H2(g)+2NO(g)=2H2O(g)+N2(g) ��H= ��
��2����С�����õ��ԭ���������ͼ1װ�ý���H2��ԭNO��ʵ��[�����ӵ����Ե�SCY�մ�(�ܴ���H+)Ϊ���ʣ������ٱ�Ĥ���缫]��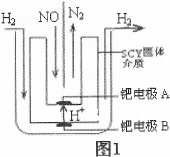
�ٵ缫AΪ �����缫��ӦʽΪ ��
��3����������ԭNOԭ�����£�
����Ӧ��4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g) (��H <0)
4N2(g)+6H2O(g) (��H <0)
����Ӧ��4NH3(g)+3O2(g) 2N2(g)+6H2O(g)
2N2(g)+6H2O(g)
4NH3(g)+ 4O2(g) 2N2O(g)+6H2O(g)
2N2O(g)+6H2O(g)
4NO(g)+4NH3(g)+3O2(g) 4N2O(g)+6H2O(g)
4N2O(g)+6H2O(g)
�й�ʵ�������ͼ2��ͼ3��ʾ���ݴ˻ش��������⣺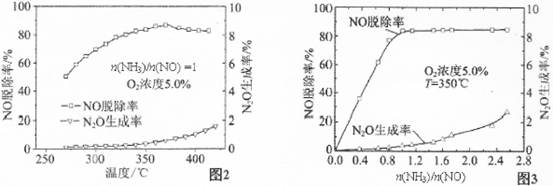
�ٴ���ԭNOӦ����n(NH3)/n(NO)�����ֵΪ �������� ��
������Ӧƽ�ⳣ������ʽ��K= �������¶ȵ����ӣ�K�� (ѡ����ӡ��� ����С�����䡱��
��Ӱ��N2O�����ʵ������� ������Ũ�Ⱥ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ijʵ��С����0.50 mol��L-1 NaOH��Һ��0.50 mol��L-1������Һ�����к��ȵIJⶨ��
������0.50 mol��L-1 NaOH��Һ
��1����ʵ���д�ԼҪʹ��245 mL NaOH��Һ��������Ҫ����NaOH�������� ��g��
��2������ͼ��ѡ�����NaOH��������Ҫ�������ǣ�����ĸ������ ������
| ���� | ������ƽ (������) | С�ձ� | ����ǯ | ������ | ҩ�� | ��Ͳ |
| ���� |  |  |  |  |  |  |
| ��� | a | b | c | d | e | f |
| �¶� ʵ������� | ��ʼ�¶�t1/�� | ��ֹ�¶�t2/�� | �¶Ȳ� ƽ��ֵ (t2-t1)/�� | ||
| H2SO4 | NaOH | ƽ��ֵ | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.6 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com