
【题目】配制250 mL 0.10 mol·L-1的NaOH溶液时,下列实验操作会使配得的溶液浓度偏大的是
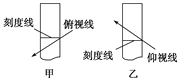
A. 转移溶液后未洗涤烧杯和玻璃棒就直接定容
B. 转移溶液时,有液体飞溅
C. 在容量瓶中定容时俯视刻度线
D. 定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度
【答案】C
【解析】试题分析:A.转移溶液后未洗涤烧杯和玻璃棒,就会有一部分溶质没有完全转移到容量瓶中。若直接定容,则由于溶质的物质的量减少,所配制的溶液浓度偏低。错误。B.移液前容量瓶中有少量蒸馏水。由于溶质的物质的量没变,溶剂的体积也没有变化,所以对溶液的浓度无影响。错误。C.若在容量瓶中进行定容时俯视刻度线,则所配制的溶液的体积偏小,由于溶质的物质的量没有变化,所以溶液的浓度就偏大。正确。D.定容后把容量瓶倒转摇匀,如果发现液面低于刻度,那是因为有一部分溶液附着在容量瓶的瓶颈上。由于溶液由均一性、稳定性。所以浓度没有变化。若再补充几滴水至刻度反而对溶液起到了稀释作用。致使溶液的浓度偏低。错误。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】工业上用甲苯生产对羟基苯甲酸乙酯:![]() ,下列反应①~⑥是其合成过程,其中某些反应条件及部分反应物或生成物未注明)。
,下列反应①~⑥是其合成过程,其中某些反应条件及部分反应物或生成物未注明)。

回答下列问题:
(1)有机物A的结构简式为___________________。
(2)反应②的化学方程式是:__________________________。
(3)试剂x是_______________,反应⑥的反应类型是_____________反应。
(4)反应⑤的化学方程式是:_______________________________。
(5)合成路线中设计③、⑤两步反应的目的是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两个连通容器用活塞分开,左右两室体积相同,左室充入一定量NO,右室充入一定量O2,且恰好使两容器内气体密度相同。打开活塞,使NO与O2充分反应,下列判断正确的是(不考虑NO2转化为N2O4)

A.开始时左右两室中的分子数相同
B.反应前后左室的压强相同
C.反应后容器内的密度与反应前的相同
D.反应后容器内无O2存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和甲烷催化合成CO和H2是CO2资源化利用的有效途径。主要反应为
Ⅰ:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) △H=+247kJ/mol
2CO(g)+2H2(g) △H=+247kJ/mol
(1)已知CH4(g)+H2O(g) ![]() CO(g)+H2(g) △H=+206kJ/mol
CO(g)+H2(g) △H=+206kJ/mol
写出CH4和水蒸气反应生成CO2的热化学方程式_________。
(2)在恒温、恒容的密闭容器中发生反应I,下列选项能够说明反应I达到平衡状态的是______。
A.混合气体的密度不变
B.混合气体的总压强不变
C.CH4、CO2、CO、H2的物质的量之比为1:1:2:2
D.3V正(H2)=V逆(CH4)
E.混合气体的平均相对分子质量不变
(3)催化合成的温度通常维持在550-750℃之间,从反应速率角度分析其主要原因可能是_________。
(4)将CH4与CO2各1mol充入某密闭容器中,发生反应I。100Kpa时,反应I到达平衡时CO2的体积分数与温度的关系曲线如图所示。
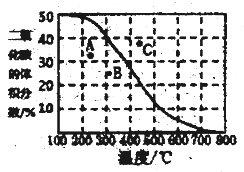
①图中A、B、C三点表示不同温度、压强下达到平衡时CO2的体积分数,则______点对应的平衡常数最小,判断依据是________;__________点对应的压强最大。
②300℃,100Kpa下,该容器中反应I经过40min达到平衡,计算反应在0-40min内的平均反应速率为v(CO2)=_________mol/min(结果保留两位有效数字),该温度下的压强平衡常数Kp=________。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的熔点或沸点比较正确的是( )
A.沸点:H2O>H2S>H2Se
B.熔点:F2>Cl2>Br2
C.沸点:CH4>SiH4>GeH4
D.熔点:Li>Na>K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、U五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为54。X的激发态原子电子排布式为2p1,Y原子的基态原子有3个不同的能级,且各能级中电子数相等,Z的基态原子中有3个未成对电子,W的电离能如下表所示,U原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态。
元素 | 第一电离能 | 第二电离能 | 第三电离能 |
W | 495.8 | 4562 | 6910.3 |
(1)U原子电子排布式为_______________。
(2)X与Z 形成的化合物Z2X4,Z原子采取的杂化轨道类型为_______,Y的最高价氧化物的水化物的正盐的阴离子的空间构型为_______;
(3)W的氯化物和Mg的氯化物中,熔点较高的是________(填化学式),原因是_______。
(4)I4O9由一种阳离子和一种阴离子按物质的量比1:3构成,阴离子的空间构型为三角锥形,中心原子杂化类型为sp3杂化,写出I4O9的电离方程式______。
(5)Nb(黑球)和I(白球)能形成一种线性的无机高分子化合物,其结构是许多八面体通过棱边而联结起来的长链,如下图所示。则该化合物中Nb和I的原子个数比为______。
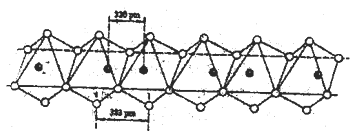
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2017新课标Ⅱ卷]阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A.1 L 0.1 mol·![]() NH4Cl溶液中,
NH4Cl溶液中,![]() 的数量为0.1
的数量为0.1![]()
B.2.4 g Mg与H2SO4完全反应,转移的电子数为0.1![]()
C.标准状况下,2.24 L N2和O2的混合气体中分子数为0.2![]()
D.0.1 mol H2和0.1 mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
A. 工业上可用铝热反应大规模炼铁
B. SO2常用于纸张等植物纤维的漂白
C. Si是重要的半导体材料
D. 电解熔融MgCl2,可制得金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 常温常压下,11.2 L N2为0.5 mol
B. 标准状况下,22.4 L H2和O2的混合气体所含分子数为NA
C. 标准状况下,18 g H2O的体积是22.4 L
D. 1 mol SO2的体积一定为22.4 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com