
【题目】CO2和甲烷催化合成CO和H2是CO2资源化利用的有效途径。主要反应为
Ⅰ:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) △H=+247kJ/mol
2CO(g)+2H2(g) △H=+247kJ/mol
(1)已知CH4(g)+H2O(g) ![]() CO(g)+H2(g) △H=+206kJ/mol
CO(g)+H2(g) △H=+206kJ/mol
写出CH4和水蒸气反应生成CO2的热化学方程式_________。
(2)在恒温、恒容的密闭容器中发生反应I,下列选项能够说明反应I达到平衡状态的是______。
A.混合气体的密度不变
B.混合气体的总压强不变
C.CH4、CO2、CO、H2的物质的量之比为1:1:2:2
D.3V正(H2)=V逆(CH4)
E.混合气体的平均相对分子质量不变
(3)催化合成的温度通常维持在550-750℃之间,从反应速率角度分析其主要原因可能是_________。
(4)将CH4与CO2各1mol充入某密闭容器中,发生反应I。100Kpa时,反应I到达平衡时CO2的体积分数与温度的关系曲线如图所示。
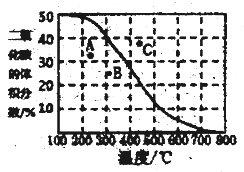
①图中A、B、C三点表示不同温度、压强下达到平衡时CO2的体积分数,则______点对应的平衡常数最小,判断依据是________;__________点对应的压强最大。
②300℃,100Kpa下,该容器中反应I经过40min达到平衡,计算反应在0-40min内的平均反应速率为v(CO2)=_________mol/min(结果保留两位有效数字),该温度下的压强平衡常数Kp=________。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
【答案】 CH4(g)+2H2O(g) ![]() CO2(g)+4H2(g) ΔH=+165kJ/mol BE 在该温度范围内,催化剂的活性较大,反应速率快(合理即给分) A 反应I吸热反应,温度降低,平衡常数减小 C 2.8×10-3 6.25KPa2
CO2(g)+4H2(g) ΔH=+165kJ/mol BE 在该温度范围内,催化剂的活性较大,反应速率快(合理即给分) A 反应I吸热反应,温度降低,平衡常数减小 C 2.8×10-3 6.25KPa2
【解析】(1)已知:①CH4(g)+H2O(g) ![]() CO(g)+H2(g) △H=+206kJ/mol
CO(g)+H2(g) △H=+206kJ/mol
②CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) △H=+247kJ/mol
2CO(g)+2H2(g) △H=+247kJ/mol
根据盖斯定律可知①×2-②即得到CH4和水蒸气反应生成CO2的热化学方程式为CH4(g)+2H2O(g) ![]() CO2(g)+4H2(g) ΔH=+165kJ/mol。(2)A. 密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此混合气体的密度不变不能说明,A错误;B.正反应体积增大,则混合气体的总压强不变说明反应达到平衡状态,B正确;C.CH4、CO2、CO、H2的物质的量之比为1:1:2:2不能说明正逆反应速率相等,则不一定处于平衡状态,C错误;D.3V正(H2)=V逆(CH4)不能满足反应速率之比是化学计量数之比,没有达到平衡状态,D错误;E. 混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以混合气体的平均相对分子质量不变说明反应达到平衡状态,E正确;答案选BE;(3)催化剂的活性受温度影响较大,因此主要原因可能是在该温度范围内,催化剂的活性较大,反应速率快。(4)①由于反应I吸热反应,温度降低,平衡常数减小,所以A点对应的平衡常数最小;C点温度最高,反应物转化率最大,由于正反应体积增大,则C点对应的压强最大。②根据方程式可知:
CO2(g)+4H2(g) ΔH=+165kJ/mol。(2)A. 密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此混合气体的密度不变不能说明,A错误;B.正反应体积增大,则混合气体的总压强不变说明反应达到平衡状态,B正确;C.CH4、CO2、CO、H2的物质的量之比为1:1:2:2不能说明正逆反应速率相等,则不一定处于平衡状态,C错误;D.3V正(H2)=V逆(CH4)不能满足反应速率之比是化学计量数之比,没有达到平衡状态,D错误;E. 混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以混合气体的平均相对分子质量不变说明反应达到平衡状态,E正确;答案选BE;(3)催化剂的活性受温度影响较大,因此主要原因可能是在该温度范围内,催化剂的活性较大,反应速率快。(4)①由于反应I吸热反应,温度降低,平衡常数减小,所以A点对应的平衡常数最小;C点温度最高,反应物转化率最大,由于正反应体积增大,则C点对应的压强最大。②根据方程式可知:
CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
起始量(mol)1 1 0 0
转化量(mol)x x 2x 2x
平衡量(mol)1-x 1-x 2x 2x
300℃,100Kpa下平衡时CO2体积分数是0.4,则![]() ,解得x=1/9,则在0-40min内的平均反应速率为v(CO2)=1/(9×40)=2.8×10-3mol/min,该温度下的压强平衡常数Kp=
,解得x=1/9,则在0-40min内的平均反应速率为v(CO2)=1/(9×40)=2.8×10-3mol/min,该温度下的压强平衡常数Kp=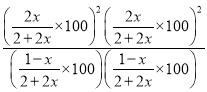 =6.25KPa2。
=6.25KPa2。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列推论正确的是( )
A. SiH4的沸点高于CH4,可推测PH3的沸点高于NH3
B. NH![]() 为正四面体结构,可推测PH
为正四面体结构,可推测PH![]() 也为正四面体结构
也为正四面体结构
C. CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体
D. C2H6是碳链为直线形的非极性分子,可推测C3H8也是碳链为直线形的非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类正确的是( )
A. SO2、SiO2、CO均为酸性氧化物
B. 稀豆浆、硅酸、氯化铁溶液均为胶体
C. 烧碱、冰醋酸、四氯化碳均为电解质
D. 漂白粉、水玻璃、氨水均为混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奥运会篮球比赛用球男女有别。男子篮球比赛用7#球,内部空间体积大约是7.35 L,比赛时内部压强约为170 kPa。己知,在25℃,100 kPa时,气体摩尔体积约为24.5 L/mol。假设比赛场馆温度为25℃,下列说法中正确的是
A.比赛时,篮球内一般充填氮气
B.比赛时,篮球内约有空气0.3 mol
C.比赛时,篮球内约有空气14.8 g
D.当25℃,170kPa时,Vm>24.5 L/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温常压下,将三个分别盛满氨气、氯化氢与空气体积比为3∶1的混合气、二氧化氮的等容积烧瓶,再分别倒置于盛水的水槽中,当水进入烧瓶中,并使气体充分溶解后,假定烧瓶中溶液无损失,所得溶液的物质的量浓度之比为
A.1∶1∶1 B.5∶5∶4 C.1∶2∶3 D.1∶1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制250 mL 0.10 mol·L-1的NaOH溶液时,下列实验操作会使配得的溶液浓度偏大的是
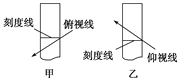
A. 转移溶液后未洗涤烧杯和玻璃棒就直接定容
B. 转移溶液时,有液体飞溅
C. 在容量瓶中定容时俯视刻度线
D. 定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.相对分子质量相同的几种化合物,互为同分异构体
B.分子组成相差一个或几个CH2原子团的物质,互为同系物
C.C5H11Cl的同分异构体(不考虑立体异构)共有8种
D.淀粉与纤维素是化学式为(C6H10O5)n的同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种因素:①温度和压强 ②所含微粒数 ③微粒本身大小 ④微粒间的距离,其中对气态物质体积有显著影响的是( )
A. ②③④ B. ②④ C. ①③④ D. ①②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com