
【题目】下列推论正确的是( )
A. SiH4的沸点高于CH4,可推测PH3的沸点高于NH3
B. NH![]() 为正四面体结构,可推测PH
为正四面体结构,可推测PH![]() 也为正四面体结构
也为正四面体结构
C. CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体
D. C2H6是碳链为直线形的非极性分子,可推测C3H8也是碳链为直线形的非极性分子
科目:高中化学 来源: 题型:
【题目】【物质结构与性质】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是____(填元素符号),其中C原子的核外电子排布式为______________;
(2)单质A有两种同素异形体,其中沸点高的是___________(填分子式),原因是_________________;A和B的氢化物所属的晶体类型分为______________和______________;
(3)C和D反应可生成组成比1:3的化合物E,E的立体构型为________________,中心原子的杂化轨道类型___________________;
(4)化合物D2A的立体构型为______________,中心原子的价层电子对数为_______________,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_____________________;
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为_________,晶胞中A原子的配位数为__________,列式计算晶体F的密度_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含少量镁粉的铝粉制取纯净的氢氧化铝,下述操作步骤中最恰当的组合是( )
①加盐酸溶解 ②加足量烧碱溶液溶解 ③过滤 ④通入过量CO2生成Al(OH)3沉淀 ⑤加入盐酸生成Al(OH)3沉淀 ⑥加入过量烧碱溶液
A. ①⑥⑤③ B. ②③④③ C. ②③⑤③ D. ①③⑤③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D四种短周期元素,A分别与B、C、D结合生成甲、乙、丙三种化合物,且甲、乙、丙三分子中含相同数目的质子数,C、D结合生成化合物丁。有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如下图所示:
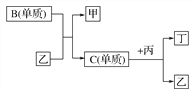
请回答下列问题:
(1)写出B+乙―→甲+C的化学反应方程式__________________________。
(2)根据以上条件可以确定A、B、C、D四种元素中的三种,不能被确定的第四种元素是________。(填写序号)
①A ②B ③C ④D
(3)依据下列条件可以进一步确定上述第四种元素:
①甲与丙以及乙与丙均能够发生反应,②甲、丙都是无色、有刺激性气味的物质。
据此,请回答下列问题:
写出上述第四种元素在周期表中的位置________。
写出C+丙―→乙+丁的化学反应方程式_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.医用酒精的浓度通常为95%
B.单质硅是将太阳能转化为电能的常用材料
C.钛合金主要用于制作飞机发动机部件,工业上可用钠与四氯化钛溶液反应制取
D.合成纤维和光导纤维都是新型无机非金属材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质所含原子数目,按由大到小顺序排列的是( )
①0.5mol NH3 ②标准状况下22.4L He ③4℃ 9mL 水 ④0.2mol H3PO4
A. ①④③② B. ④③②①
C. ②③④① D. ①④②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用甲苯生产对羟基苯甲酸乙酯:![]() ,下列反应①~⑥是其合成过程,其中某些反应条件及部分反应物或生成物未注明)。
,下列反应①~⑥是其合成过程,其中某些反应条件及部分反应物或生成物未注明)。

回答下列问题:
(1)有机物A的结构简式为___________________。
(2)反应②的化学方程式是:__________________________。
(3)试剂x是_______________,反应⑥的反应类型是_____________反应。
(4)反应⑤的化学方程式是:_______________________________。
(5)合成路线中设计③、⑤两步反应的目的是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积的硫酸铝、硫酸锌、硫酸钠溶液分别与足量氯化钡溶液反应,若生成硫酸钡沉淀的质量比为2∶2∶3,则三种硫酸盐的物质的量浓度之比为
A. 1∶2∶3 B. 2∶2∶3 C. 3∶2∶2 D. 2∶6∶9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和甲烷催化合成CO和H2是CO2资源化利用的有效途径。主要反应为
Ⅰ:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) △H=+247kJ/mol
2CO(g)+2H2(g) △H=+247kJ/mol
(1)已知CH4(g)+H2O(g) ![]() CO(g)+H2(g) △H=+206kJ/mol
CO(g)+H2(g) △H=+206kJ/mol
写出CH4和水蒸气反应生成CO2的热化学方程式_________。
(2)在恒温、恒容的密闭容器中发生反应I,下列选项能够说明反应I达到平衡状态的是______。
A.混合气体的密度不变
B.混合气体的总压强不变
C.CH4、CO2、CO、H2的物质的量之比为1:1:2:2
D.3V正(H2)=V逆(CH4)
E.混合气体的平均相对分子质量不变
(3)催化合成的温度通常维持在550-750℃之间,从反应速率角度分析其主要原因可能是_________。
(4)将CH4与CO2各1mol充入某密闭容器中,发生反应I。100Kpa时,反应I到达平衡时CO2的体积分数与温度的关系曲线如图所示。
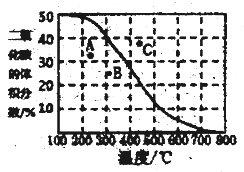
①图中A、B、C三点表示不同温度、压强下达到平衡时CO2的体积分数,则______点对应的平衡常数最小,判断依据是________;__________点对应的压强最大。
②300℃,100Kpa下,该容器中反应I经过40min达到平衡,计算反应在0-40min内的平均反应速率为v(CO2)=_________mol/min(结果保留两位有效数字),该温度下的压强平衡常数Kp=________。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com