
【题目】如图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列判断正确的是

A. a为负极、b为正极
B. 电解过程中,c电极上发生氧化反应
C. d为阳极,电极反应为:2Cl―2e-=Cl2↑
D. 电解过程中,化学能转化为电能
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在恒温、体积为2L的密闭容器中加入1molCO2和3molH2,发生如下的反应:CO2(g) +3H2(g)![]() CH3OH(g) +H2O(g) △H<0。可认定该可逆反应在一定条件下已达到化学平衡状态的是( )
CH3OH(g) +H2O(g) △H<0。可认定该可逆反应在一定条件下已达到化学平衡状态的是( )
A. 容器中CO2、H2、CH3OH、H2O的物质的量之比为1∶3∶1 ∶1B. v正(CO2)=v逆(H2O)
C. 容器内混合气体密度保持不变D. 3molH-H键断裂同时断裂3molH-O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图提供的信息,下列所得结论不正确的是
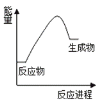
A. 该反应是吸热反应
B. 因为生成物的总能量高于反应物的总能量,所以该反应一定需要加热才能发生
C. 该反应反应物断裂旧键所吸收的能量高于生成物形成新键放出的能量
D. 该反应可能是碳酸钙分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g) + O2(g) ![]() 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中,正确的是
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中,正确的是
甲 | 乙 | 丙 | ||
起始物质的量 | n(SO2) / mol | 0.4 | 0.8 | 0.8 |
n(O2) / mol | 0.24 | 0.24 | 0.48 | |
SO2的平衡转化率 / % | 80 | α1 | α2 | |
A. 甲中反应的平衡常数小于乙
B. 平衡时,丙中c(SO3)是甲中的2倍
C. 该温度下,平衡常数值为400
D. 平衡时,甲中O2的转化率大于乙中O2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.离子化合物中可能含有共价键
B.分子晶体中的分子内不含有共价键
C.分子晶体中一定有非极性共价键
D.分子晶体中分子一定紧密堆积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常利用含硫废水生产 Na2S2O3·5H2O,实验室可用如图装置(略去部分夹持仪器)模拟生产过程
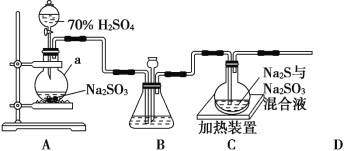
(1)仪器a的名称是__________,A中发生的化学反应方程为_______________________;
(2)实验中,为使 SO2 缓慢进入装置C,采用的操作______________,装置C中制备反应结束的现象___________________;
(3)装置 C 中的溶液一般需控制在碱性环境,否则产品发黄,用离子方程式表示其原因为 ___________________;
(4)为减少装置C中可能出现的Na2SO4杂质,在不改变原有装置的基础上应采取的操作是__________________;
(5)装置 D 用于处理尾气,可选用的最合理装置(夹持仪器已略去)为_____(填序号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)1 mol石墨转变成金刚石需要吸收1.9 kJ的热量该反应的热化学方程式是__________。
(2)在25℃、101kPa下,一定质量的无水乙醇完全燃烧时放出热量QkJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100gCaCO3沉淀,则乙醇燃烧的热化学方程式为_________。
(3)已知下列热化学方程式
Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1 ①
3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1 ②
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH3=+19 kJ·mol-1 ③
写出FeO(s)被CO还原成Fe和CO2的热化学方程式_________________。
(4)向足量H2SO4溶液中加入100 mL 0.4 mol·L-1Ba(OH)2溶液,放出的热量是5.12 kJ。如果向足量Ba(OH)2溶液中加入100 mL 0.4 mol·L-1盐酸时,放出的热量为2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫铁矿(FeS2的质量分数为60%)为原料制备氯化铁晶体(FeCl3·6H2O,270.5g·moˉ1)的工艺流程如图所示。

请回答下列问题:
(1)为加快焙烧反应的化学反应速率,可采取的措施为_____、_____。(任写两条)
(2)焙烧后得到的Fe2O3在酸溶过程中发生反应的离子方程式为________。
(3)过滤操作用到的玻璃仪器有烧杯、_______、______。
(4)焙烧过程中产生的SO2可用过量的氨水进行吸收,所得溶液中溶质的名称为_______。
(5)先向氯化铁溶液中加适量盐酸的目的是______,再______、______、过滤、洗涤,最终得到氯化铁晶体。
(6)若取1kg硫铁矿经过上述流程(铁元素在整个流程中损失率为4%),则可得氯化铁晶体的质量为_______(保留一位小数)kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cr、Fe、Ni单质及化合物有重要的用途。
(1)用Cr2O3作原料,铝粉作还原剂的铝热法是生产金属铬的主要方法之一,该反应是一个自发放热反应,由此可判断Cr—O键和Al—O键中____________键更强。研究发现气态氯化铝(Al2Cl6)是具有配位键的化合物,可溶于非极性溶剂,由此可知该分子是______(填“极性”或“非极性”)的。
(2)铁有α、γ、δ三种晶体构型,其中α-Fe单质为体心立方晶体,δ-Fe单质为简单立方晶体。则这两种晶体结构中铁原子的配位数之比是______。
(3)FeS2晶体的晶胞如下图所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3;晶胞中Fe2+位于S22—所形成的正八面体的体心,该正八面体的边长为______nm。

(4)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是__________。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为__________,提供孤电子对的成键原子是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com