
【题目】工业上常利用含硫废水生产 Na2S2O3·5H2O,实验室可用如图装置(略去部分夹持仪器)模拟生产过程
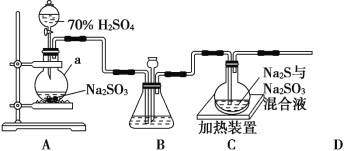
(1)仪器a的名称是__________,A中发生的化学反应方程为_______________________;
(2)实验中,为使 SO2 缓慢进入装置C,采用的操作______________,装置C中制备反应结束的现象___________________;
(3)装置 C 中的溶液一般需控制在碱性环境,否则产品发黄,用离子方程式表示其原因为 ___________________;
(4)为减少装置C中可能出现的Na2SO4杂质,在不改变原有装置的基础上应采取的操作是__________________;
(5)装置 D 用于处理尾气,可选用的最合理装置(夹持仪器已略去)为_____(填序号)。

【答案】圆底烧瓶 H2SO4+Na2SO3=Na2SO4+SO2↑+H2O 控制滴加硫酸的速度 溶液重新变澄清 S2O32-+2H+=S↓+SO2↑+H2O 先通一段时间的SO2,再加热装置C d
【解析】
(1)仪器a为圆底烧瓶,A中发生的反应为浓硫酸和亚硫酸钠反应生成二氧化硫气体的反应;
(2)分液漏斗有玻璃活塞,通过控制分液漏斗的活塞控制滴加硫酸的速度,可以控制产生二氧化硫的速率,所以为使SO2缓慢进入烧瓶C,采用的操作是控制滴加硫酸的速度,根据C中发生的反应可知,烧瓶C中反应达到终点发生反应为硫与亚硫酸钠反应生成硫代硫酸钠,反应的现象为溶液重新变澄清;
(3)酸性溶液中硫代硫酸根离子会反应生成单质硫;
(4)先通一会二氧化硫气体把空气排净,再打开加热装置,避免了亚硫酸钠被氧化为硫酸钠;
(5)根据二氧化硫的性质选用合理的尾气装置。
(1)仪器a为圆底烧瓶,A中发生的反应为浓硫酸和亚硫酸钠反应生成二氧化硫气体的反应,化学方程式为:H2SO4+Na2SO3=Na2SO4+SO2↑+H2O,故答案为:圆底烧瓶;Na2SO3+H2SO4═Na2SO4+SO2↑+H2O。
(2)分液漏斗有玻璃活塞,通过控制分液漏斗的活塞控制滴加硫酸的速度,可以控制产生二氧化硫的速率,所以为使SO2缓慢进入烧瓶C,采用的操作是控制滴加硫酸的速度,根据C中发生的反应可知,烧瓶C中反应达到终点发生反应为硫与亚硫酸钠反应生成硫代硫酸钠,反应的现象为溶液重新变澄清,故答案为:控制滴加硫酸的速度;溶液重新变澄清。
(3)酸性溶液中硫代硫酸根离子会反应生成单质硫,产品发黄,反应的离子方程式为:S2O32-+2H+═S↓+SO2↑+H2O,故答案为:S2O32-+2H+═S↓+SO2↑+H2O。
(4)为减少装置C中常可能出现的Na2SO4杂质,在不改变原有装置的基础上先通一会二氧化硫气体把空气排净,再打开加热装置,避免了亚硫酸钠被氧化为硫酸钠,故答案为:先通一段时间SO2,再打开加热装置C。
(5)a.装置应将导管深入氨水中可以吸收二氧化硫,但为密闭环境,装置内压强增大易产生安全事故,故a错误;
b.该装置吸收二氧化硫能力较差,且为密闭环境,装置内压强增大易产生安全事故,故b错误;
c.该装置不能吸收二氧化硫,所以无法实现实验目的,故c错误;
d.该装置中氢氧化钠与二氧化硫反应,可以吸收,且防止倒吸,故d正确。
故答案为:d。


 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】根据如下能量关系示意图,下列说法正确的是

A. 1 mol C(g)与1 mol O2(g)的能量之和为393.5 kJ
B. 反应2CO(g)+O2(g) ==2CO2(g)中,生成物的总能量大于反应物的总能量
C. 由C→CO的热化学方程式为:2C(s)+O2(g) ==2CO(g) ΔH= 221.2 kJmol1
D. 热值指一定条件下单位质量的物质完全燃烧所放出热量,则CO热值ΔH= 10.1 kJmol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水资源开发利用的部分过程如下图所示(苦卤中主要含 K+、Mg2+、Br-等),下列说法错误的是
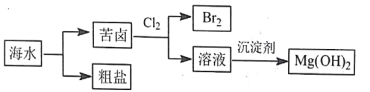
A. 从海水得到粗盐主要通过蒸发操作实现
B. 向苦卤中通入 Cl2 时溴离子被还原为 Br2
C. 富集溴涉及的离子反应有 Br2+SO2+2H2O==2Br-+4H++SO42-
D. 工业选用的沉淀剂通常经煅烧碳酸钙获得而不是电解食盐水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d 四种物质之间的转化关系如图所示(部分产物略去),下列说法正确的是

A. 若 a 为 Cl2,b 可能为 NH3,实验室可用加热固体 c 的方法制取 NH3
B. 若 a 为 Fe,b 可能为稀 HNO3,反应②的离子方程式为3Fe+8H++2NO3-===3Fe2++2NO2↑+4H2O
C. 若 a 为 AlCl3 溶液,b 可能为氨水,反应①的离子方程式为Al3++4NH3 ·H2O===AlO2-+4NH4++2H2O
D. 若 a 为 NaOH 溶液,b 可能为 CO2,可用 Ca(OH)2 溶液鉴定 c、d 溶液中的阴离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列判断正确的是

A. a为负极、b为正极
B. 电解过程中,c电极上发生氧化反应
C. d为阳极,电极反应为:2Cl―2e-=Cl2↑
D. 电解过程中,化学能转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】血液中的葡萄糖称为血糖,空腹血糖是筛査糖尿病的常用指标,正常范围在3.9-6.1mmol/L(注:1m mol/L= 1×10-3 mol/L);该体检指标表示的是
A.物质的量(n)B.物质的量浓度(c)C.质量分数(ω)D.摩尔质量(M)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅及其化合物的说法正确的是
A.硅在自然界中以游离态和化合态两种形式存在
B.硅晶体是良好的半导体,可用于制造光导纤维
C.木材浸过水玻璃后,不易着火
D.SiO2是酸性氧化物,不与任何酸发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示。请回答:

(1)若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Zn,A极材料为铜,该装置能量转换形式____, A为____极,此电池所发生的反应化学方程式为_____,反应进行一段时间后溶液C中c(H+)将_____(填“变大” “变小”或“基本不变”)。溶液中的SO42-移向____极(填“A”或“B”)
(2)若C为CuSO4溶液,B电极材料为Fe,A极材料为石墨。则B为_____极,B极上电极反应属于____(填“氧化反应”或“还原反应”)。B电极上发生的电极反应式为______,A极产生的现象是_____;若AB两电极质量都为50.0g且反应过程中有0.2mol的电子发生转移,理论上AB两电极质量差为____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙是元素周期表中同一主族的两种元素,若甲的原子序数为 x,则乙的原子序数不可能是
A. x﹣2 B. x+4 C. x+8 D. x+18
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com