
【题目】下列有关硅及其化合物的说法正确的是
A.硅在自然界中以游离态和化合态两种形式存在
B.硅晶体是良好的半导体,可用于制造光导纤维
C.木材浸过水玻璃后,不易着火
D.SiO2是酸性氧化物,不与任何酸发生反应
科目:高中化学 来源: 题型:
【题目】过氧化氢一定条件下可发生分解:2H2O2(l)=2H2O(l)+O2(g),其能量变化如下图所示,下列说法正确的是

A.该分解反应为吸热反应
B.2molH2O2具有的能量小于2molH2O和1molO2所具有的总能量
C.加入MnO2或FeCl3均可提高该分解反应的速率
D.其他条件相同时,H2O2溶液的浓度越大,其分解速率越慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g) + O2(g) ![]() 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中,正确的是
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中,正确的是
甲 | 乙 | 丙 | ||
起始物质的量 | n(SO2) / mol | 0.4 | 0.8 | 0.8 |
n(O2) / mol | 0.24 | 0.24 | 0.48 | |
SO2的平衡转化率 / % | 80 | α1 | α2 | |
A. 甲中反应的平衡常数小于乙
B. 平衡时,丙中c(SO3)是甲中的2倍
C. 该温度下,平衡常数值为400
D. 平衡时,甲中O2的转化率大于乙中O2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常利用含硫废水生产 Na2S2O3·5H2O,实验室可用如图装置(略去部分夹持仪器)模拟生产过程
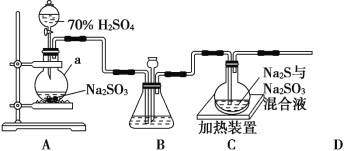
(1)仪器a的名称是__________,A中发生的化学反应方程为_______________________;
(2)实验中,为使 SO2 缓慢进入装置C,采用的操作______________,装置C中制备反应结束的现象___________________;
(3)装置 C 中的溶液一般需控制在碱性环境,否则产品发黄,用离子方程式表示其原因为 ___________________;
(4)为减少装置C中可能出现的Na2SO4杂质,在不改变原有装置的基础上应采取的操作是__________________;
(5)装置 D 用于处理尾气,可选用的最合理装置(夹持仪器已略去)为_____(填序号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)1 mol石墨转变成金刚石需要吸收1.9 kJ的热量该反应的热化学方程式是__________。
(2)在25℃、101kPa下,一定质量的无水乙醇完全燃烧时放出热量QkJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100gCaCO3沉淀,则乙醇燃烧的热化学方程式为_________。
(3)已知下列热化学方程式
Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1 ①
3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1 ②
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH3=+19 kJ·mol-1 ③
写出FeO(s)被CO还原成Fe和CO2的热化学方程式_________________。
(4)向足量H2SO4溶液中加入100 mL 0.4 mol·L-1Ba(OH)2溶液,放出的热量是5.12 kJ。如果向足量Ba(OH)2溶液中加入100 mL 0.4 mol·L-1盐酸时,放出的热量为2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾、氟及锌的相关化合物用途非常广泛。回答下列问题:
(1)基态锌原子的价电子排布式为___________;K、F、Zn的电负性从大到小的顺序为___________。
(2)Zn与Ca位于同一周期且最外层电子数相等,钙的熔点与沸点均比锌高,其原因是_______________。
(3)OF2分子的几何构型为___________,中心原子的杂化类型为___________。
(4)KOH 与O3反应可得到KO3(臭氧化钾),KO3 中除σ键外,还存在___________;与O3-互为等电子体的分子为___________ (任 写一种 )。
(5)K、F、Zn组成的一种晶体结构如图所示,其晶胞参数为a=0.4058 nm。

①晶胞中Zn2+的配位数为___________个。
②晶胞中紧邻的两个F-间的距离为_______________________(列出算式即可)nm。
③该晶体的密度为___________(列出算式即可,用NA表示阿伏加德罗常数的数值)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫铁矿(FeS2的质量分数为60%)为原料制备氯化铁晶体(FeCl3·6H2O,270.5g·moˉ1)的工艺流程如图所示。

请回答下列问题:
(1)为加快焙烧反应的化学反应速率,可采取的措施为_____、_____。(任写两条)
(2)焙烧后得到的Fe2O3在酸溶过程中发生反应的离子方程式为________。
(3)过滤操作用到的玻璃仪器有烧杯、_______、______。
(4)焙烧过程中产生的SO2可用过量的氨水进行吸收,所得溶液中溶质的名称为_______。
(5)先向氯化铁溶液中加适量盐酸的目的是______,再______、______、过滤、洗涤,最终得到氯化铁晶体。
(6)若取1kg硫铁矿经过上述流程(铁元素在整个流程中损失率为4%),则可得氯化铁晶体的质量为_______(保留一位小数)kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、NO、CO等污染物的处理对建设美丽中国具有重要意义。
(1)利用甲烷催化还原NOx:
CH4(g)+4NO2(g) ===4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g) ===2N2(g)+CO2(g)+2H2O(g) ΔH2=-1160 kJ·mol-1
①甲烷直接将NO2还原为N2的热化学方程式为________________________________。
②将CH4和NO2充入密闭容器中发生上述反应,该反应达到平衡后,为了提高反应速率的同时提高NO2的转化率,可采取的措施有__________(写一点即可)。
③利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3===7N2+12H2O,电解质溶液为NaOH溶液,工作一段时间后,该电池正极区附近溶液pH________(填“增大”、“减小”或“不变”),负极的电极反应式为___________________。
(2)光气(COCl2)在塑料、制革、制药等工业中有许多用途。工业上常利用废气CO2通过反应:C(s)+CO2(g)![]() 2CO(g) ΔH>0,制取合成光气的原料气CO。在体积可变的恒压(p总)密闭容器中充入1mol CO2 与足量的碳发生上述反应,在平衡时体系中气体体积分数与温度的关系如图所示:
2CO(g) ΔH>0,制取合成光气的原料气CO。在体积可变的恒压(p总)密闭容器中充入1mol CO2 与足量的碳发生上述反应,在平衡时体系中气体体积分数与温度的关系如图所示:
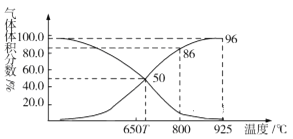
①T℃时,在容器中若充入稀有气体,平衡______移动(填“正向”“逆向”或“不”,下同);若充入等体积的CO2和CO,平衡________移动。
②CO体积分数为40%时,CO2的转化率为_______。
③已知:气体分压(p分)=气体总压×体积分数。800℃时用平衡分压代替平衡浓度表示平衡常数Kp=______(用含p总的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com