
【题目】研究NO2、NO、CO等污染物的处理对建设美丽中国具有重要意义。
(1)利用甲烷催化还原NOx:
CH4(g)+4NO2(g) ===4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g) ===2N2(g)+CO2(g)+2H2O(g) ΔH2=-1160 kJ·mol-1
①甲烷直接将NO2还原为N2的热化学方程式为________________________________。
②将CH4和NO2充入密闭容器中发生上述反应,该反应达到平衡后,为了提高反应速率的同时提高NO2的转化率,可采取的措施有__________(写一点即可)。
③利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3===7N2+12H2O,电解质溶液为NaOH溶液,工作一段时间后,该电池正极区附近溶液pH________(填“增大”、“减小”或“不变”),负极的电极反应式为___________________。
(2)光气(COCl2)在塑料、制革、制药等工业中有许多用途。工业上常利用废气CO2通过反应:C(s)+CO2(g)![]() 2CO(g) ΔH>0,制取合成光气的原料气CO。在体积可变的恒压(p总)密闭容器中充入1mol CO2 与足量的碳发生上述反应,在平衡时体系中气体体积分数与温度的关系如图所示:
2CO(g) ΔH>0,制取合成光气的原料气CO。在体积可变的恒压(p总)密闭容器中充入1mol CO2 与足量的碳发生上述反应,在平衡时体系中气体体积分数与温度的关系如图所示:
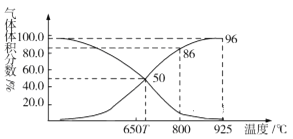
①T℃时,在容器中若充入稀有气体,平衡______移动(填“正向”“逆向”或“不”,下同);若充入等体积的CO2和CO,平衡________移动。
②CO体积分数为40%时,CO2的转化率为_______。
③已知:气体分压(p分)=气体总压×体积分数。800℃时用平衡分压代替平衡浓度表示平衡常数Kp=______(用含p总的代数式表示)。
【答案】CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ·mol-1 增大CH4的浓度 增大 2NH3-6e-+6OH-=N2+6H2O 正向 不 25% 5.28p总
【解析】
(1) ①ⅠCH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
ⅡCH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ·mol-1
根据盖斯定律,由![]() (Ⅰ+Ⅱ)得反应CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=
(Ⅰ+Ⅱ)得反应CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=![]() (△H1+△H2)=
(△H1+△H2)=![]() (-574 kJ·mol-1-1160 kJ·mol-1)=-867 kJ·mol-1;
(-574 kJ·mol-1-1160 kJ·mol-1)=-867 kJ·mol-1;
②将CH4和NO2充入密闭容器中发生上述反应,该反应达到平衡后,增大CH4的浓度,反应速率增大,反应正向移动,NO2的转化率增大;
③正极反应式为2NO2+8e-+4H2O=N2+8OH-,产生OH-,c(OH-)增大,pH增大,NO2在正极上反应,NO2得到电子;负极区失去电子,化合价升高,因此NH3在负极反应,反应式为2NH3-6e-+6OH-=N2+6H2O;
(2)①该反应正向为气体分子数增大的反应,恒温恒压时充入稀有气体,对该反应来说相当于减压,v(正)>v(逆),平衡正向移动;T ℃时,反应达到平衡时CO2、CO的体积分数相同,即浓度相等,恒压条件下充入等体积的CO2和CO,各物质的浓度都不变,故平衡不移动;
②设CO2的转化率为a,由已知列三段式得:
化学反应方程式: C(s)+ CO2(g) ![]() 2CO(g)
2CO(g)
起始物质的量/mol 1 0
转化物质的量mol a 2a
平衡物质的量/mol 1-a 2a
根据题意列关系式: ![]() ×100%=40%,解得: a=25%;
×100%=40%,解得: a=25%;
③用平衡浓度表示该反应化学平衡常数表达式为K=![]() ,所以若用平衡分压代替平衡浓度表示平衡常数的表达式为Kp=
,所以若用平衡分压代替平衡浓度表示平衡常数的表达式为Kp=![]() ,由图可得,800℃时CO体积分数为86%,分压为86%×p总, CO2体积分数为14%,分压为14%×p总,所以Kp=
,由图可得,800℃时CO体积分数为86%,分压为86%×p总, CO2体积分数为14%,分压为14%×p总,所以Kp=![]() =
=![]() =5.28p总。
=5.28p总。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】海水资源开发利用的部分过程如下图所示(苦卤中主要含 K+、Mg2+、Br-等),下列说法错误的是
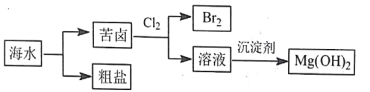
A. 从海水得到粗盐主要通过蒸发操作实现
B. 向苦卤中通入 Cl2 时溴离子被还原为 Br2
C. 富集溴涉及的离子反应有 Br2+SO2+2H2O==2Br-+4H++SO42-
D. 工业选用的沉淀剂通常经煅烧碳酸钙获得而不是电解食盐水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅及其化合物的说法正确的是
A.硅在自然界中以游离态和化合态两种形式存在
B.硅晶体是良好的半导体,可用于制造光导纤维
C.木材浸过水玻璃后,不易着火
D.SiO2是酸性氧化物,不与任何酸发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示。请回答:

(1)若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Zn,A极材料为铜,该装置能量转换形式____, A为____极,此电池所发生的反应化学方程式为_____,反应进行一段时间后溶液C中c(H+)将_____(填“变大” “变小”或“基本不变”)。溶液中的SO42-移向____极(填“A”或“B”)
(2)若C为CuSO4溶液,B电极材料为Fe,A极材料为石墨。则B为_____极,B极上电极反应属于____(填“氧化反应”或“还原反应”)。B电极上发生的电极反应式为______,A极产生的现象是_____;若AB两电极质量都为50.0g且反应过程中有0.2mol的电子发生转移,理论上AB两电极质量差为____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化合物中的所有原子可能都在同一平面上的是
A.CH3(CH2)4CH3B.CH3CH2CHO
C.CH2=CHCH=CH2D.(CH3)3C-C≡C-CH=CHCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述及解释正确的是
A. 2NO2(g)(红棕色)![]() N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
B. H2(g)+I2(g)![]() 2HI(g) ΔH<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变
2HI(g) ΔH<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变
C. FeCl3+3KSCN![]() Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅
Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅
D. 对于N2+3H2![]() 2NH3,平衡后,压强不变,充入O2,平衡左移
2NH3,平衡后,压强不变,充入O2,平衡左移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙是元素周期表中同一主族的两种元素,若甲的原子序数为 x,则乙的原子序数不可能是
A. x﹣2 B. x+4 C. x+8 D. x+18
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标况下) | 50 | 120 | 232 | 290 | 310 |
⑴ 哪一时间段(指①0~1、②1~2、③2~3、④3~4、⑤4~5 min,下同)反应速率最大______ (填序号,下同),原因是_____________________________ 。
⑵ 哪一段时段的反应速率最小______,原因是________________________。
⑶ 求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变,不要求写出计算过程)_________________ 。
⑷ 如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液: A..蒸馏水 B.KNO3溶液 C. NaCl溶液 D.CuSO4溶液
你认为可行的是(填编号) _______________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com