
【题目】海水资源开发利用的部分过程如下图所示(苦卤中主要含 K+、Mg2+、Br-等),下列说法错误的是
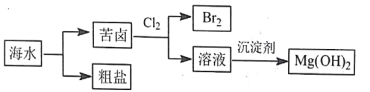
A. 从海水得到粗盐主要通过蒸发操作实现
B. 向苦卤中通入 Cl2 时溴离子被还原为 Br2
C. 富集溴涉及的离子反应有 Br2+SO2+2H2O==2Br-+4H++SO42-
D. 工业选用的沉淀剂通常经煅烧碳酸钙获得而不是电解食盐水
科目:高中化学 来源: 题型:
【题目】新型纤维酸类降脂药克利贝特可由物质X在一定条件下反应制得:( )
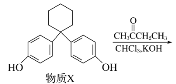
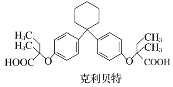
下列有关叙述正确的是( )
A. 克利贝特的分子式为C28H36O5
B. 物质X分子中所有碳原子可能位于同一平面内
C. 1 mol物质X最多可以与含2 mol Br2的溴水反应
D. 用饱和NaHCO3溶液可以鉴别物质X和克利贝特
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢一定条件下可发生分解:2H2O2(l)=2H2O(l)+O2(g),其能量变化如下图所示,下列说法正确的是

A.该分解反应为吸热反应
B.2molH2O2具有的能量小于2molH2O和1molO2所具有的总能量
C.加入MnO2或FeCl3均可提高该分解反应的速率
D.其他条件相同时,H2O2溶液的浓度越大,其分解速率越慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图提供的信息,下列所得结论不正确的是
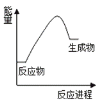
A. 该反应是吸热反应
B. 因为生成物的总能量高于反应物的总能量,所以该反应一定需要加热才能发生
C. 该反应反应物断裂旧键所吸收的能量高于生成物形成新键放出的能量
D. 该反应可能是碳酸钙分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,1.68L无色的可燃气体在足量氧气中完全燃烧。若将产物通入足量澄清石灰水中,得到白色沉淀质量为15g;若用足量碱石灰吸收燃烧产物,增重9.3g。
(1)燃烧产物中水的质量为_______ g。
(2)若原气体是单一气体,则其分子式为_____________________。
(3)若原气体是由两种等物质的量的气态烃组成的混合物,请写出他们的分子式__________________。(请写出两组)
(4)若原气体是由两种等物质的量的气体组成的混合物,其中只有一种是烃,请写出他们的分子式____________________________。(请写出两组)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g) + O2(g) ![]() 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中,正确的是
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中,正确的是
甲 | 乙 | 丙 | ||
起始物质的量 | n(SO2) / mol | 0.4 | 0.8 | 0.8 |
n(O2) / mol | 0.24 | 0.24 | 0.48 | |
SO2的平衡转化率 / % | 80 | α1 | α2 | |
A. 甲中反应的平衡常数小于乙
B. 平衡时,丙中c(SO3)是甲中的2倍
C. 该温度下,平衡常数值为400
D. 平衡时,甲中O2的转化率大于乙中O2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常利用含硫废水生产 Na2S2O3·5H2O,实验室可用如图装置(略去部分夹持仪器)模拟生产过程
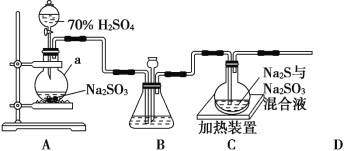
(1)仪器a的名称是__________,A中发生的化学反应方程为_______________________;
(2)实验中,为使 SO2 缓慢进入装置C,采用的操作______________,装置C中制备反应结束的现象___________________;
(3)装置 C 中的溶液一般需控制在碱性环境,否则产品发黄,用离子方程式表示其原因为 ___________________;
(4)为减少装置C中可能出现的Na2SO4杂质,在不改变原有装置的基础上应采取的操作是__________________;
(5)装置 D 用于处理尾气,可选用的最合理装置(夹持仪器已略去)为_____(填序号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、NO、CO等污染物的处理对建设美丽中国具有重要意义。
(1)利用甲烷催化还原NOx:
CH4(g)+4NO2(g) ===4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g) ===2N2(g)+CO2(g)+2H2O(g) ΔH2=-1160 kJ·mol-1
①甲烷直接将NO2还原为N2的热化学方程式为________________________________。
②将CH4和NO2充入密闭容器中发生上述反应,该反应达到平衡后,为了提高反应速率的同时提高NO2的转化率,可采取的措施有__________(写一点即可)。
③利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3===7N2+12H2O,电解质溶液为NaOH溶液,工作一段时间后,该电池正极区附近溶液pH________(填“增大”、“减小”或“不变”),负极的电极反应式为___________________。
(2)光气(COCl2)在塑料、制革、制药等工业中有许多用途。工业上常利用废气CO2通过反应:C(s)+CO2(g)![]() 2CO(g) ΔH>0,制取合成光气的原料气CO。在体积可变的恒压(p总)密闭容器中充入1mol CO2 与足量的碳发生上述反应,在平衡时体系中气体体积分数与温度的关系如图所示:
2CO(g) ΔH>0,制取合成光气的原料气CO。在体积可变的恒压(p总)密闭容器中充入1mol CO2 与足量的碳发生上述反应,在平衡时体系中气体体积分数与温度的关系如图所示:
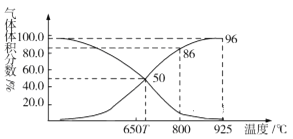
①T℃时,在容器中若充入稀有气体,平衡______移动(填“正向”“逆向”或“不”,下同);若充入等体积的CO2和CO,平衡________移动。
②CO体积分数为40%时,CO2的转化率为_______。
③已知:气体分压(p分)=气体总压×体积分数。800℃时用平衡分压代替平衡浓度表示平衡常数Kp=______(用含p总的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com