
【题目】下列化合物中的所有原子可能都在同一平面上的是
A.CH3(CH2)4CH3B.CH3CH2CHO
C.CH2=CHCH=CH2D.(CH3)3C-C≡C-CH=CHCH3
 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】根据下图提供的信息,下列所得结论不正确的是
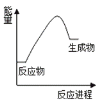
A. 该反应是吸热反应
B. 因为生成物的总能量高于反应物的总能量,所以该反应一定需要加热才能发生
C. 该反应反应物断裂旧键所吸收的能量高于生成物形成新键放出的能量
D. 该反应可能是碳酸钙分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)1 mol石墨转变成金刚石需要吸收1.9 kJ的热量该反应的热化学方程式是__________。
(2)在25℃、101kPa下,一定质量的无水乙醇完全燃烧时放出热量QkJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100gCaCO3沉淀,则乙醇燃烧的热化学方程式为_________。
(3)已知下列热化学方程式
Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1 ①
3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1 ②
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH3=+19 kJ·mol-1 ③
写出FeO(s)被CO还原成Fe和CO2的热化学方程式_________________。
(4)向足量H2SO4溶液中加入100 mL 0.4 mol·L-1Ba(OH)2溶液,放出的热量是5.12 kJ。如果向足量Ba(OH)2溶液中加入100 mL 0.4 mol·L-1盐酸时,放出的热量为2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫铁矿(FeS2的质量分数为60%)为原料制备氯化铁晶体(FeCl3·6H2O,270.5g·moˉ1)的工艺流程如图所示。

请回答下列问题:
(1)为加快焙烧反应的化学反应速率,可采取的措施为_____、_____。(任写两条)
(2)焙烧后得到的Fe2O3在酸溶过程中发生反应的离子方程式为________。
(3)过滤操作用到的玻璃仪器有烧杯、_______、______。
(4)焙烧过程中产生的SO2可用过量的氨水进行吸收,所得溶液中溶质的名称为_______。
(5)先向氯化铁溶液中加适量盐酸的目的是______,再______、______、过滤、洗涤,最终得到氯化铁晶体。
(6)若取1kg硫铁矿经过上述流程(铁元素在整个流程中损失率为4%),则可得氯化铁晶体的质量为_______(保留一位小数)kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家成功实现甲烷在催化剂及无氧条件下,一步高效生产乙烯、芳烃和氢气等化学品,为天然气化工开发了一条革命性技术。以甲烷为原料合成部分化工产品流程如下(部分反应条件已略去):

(1)E 的名称为____,B物质的结构简式:______;
(2)上述③~⑥转化反应中,属于取代反应的有______(用反应序号填写);
(3)写出反应⑦的反应方程式:______;
(4)如图为实验室制取E的装置图,图中a试剂为_______;

(5)某同学在试管b中加入6.0克乙酸和足量乙醇采用适当条件使反应充分进行,结束后在试管b回收到3.0克乙酸,则该同学在本次实验中制得乙酸乙酯的最大质量为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、NO、CO等污染物的处理对建设美丽中国具有重要意义。
(1)利用甲烷催化还原NOx:
CH4(g)+4NO2(g) ===4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g) ===2N2(g)+CO2(g)+2H2O(g) ΔH2=-1160 kJ·mol-1
①甲烷直接将NO2还原为N2的热化学方程式为________________________________。
②将CH4和NO2充入密闭容器中发生上述反应,该反应达到平衡后,为了提高反应速率的同时提高NO2的转化率,可采取的措施有__________(写一点即可)。
③利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3===7N2+12H2O,电解质溶液为NaOH溶液,工作一段时间后,该电池正极区附近溶液pH________(填“增大”、“减小”或“不变”),负极的电极反应式为___________________。
(2)光气(COCl2)在塑料、制革、制药等工业中有许多用途。工业上常利用废气CO2通过反应:C(s)+CO2(g)![]() 2CO(g) ΔH>0,制取合成光气的原料气CO。在体积可变的恒压(p总)密闭容器中充入1mol CO2 与足量的碳发生上述反应,在平衡时体系中气体体积分数与温度的关系如图所示:
2CO(g) ΔH>0,制取合成光气的原料气CO。在体积可变的恒压(p总)密闭容器中充入1mol CO2 与足量的碳发生上述反应,在平衡时体系中气体体积分数与温度的关系如图所示:
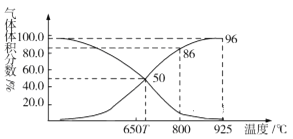
①T℃时,在容器中若充入稀有气体,平衡______移动(填“正向”“逆向”或“不”,下同);若充入等体积的CO2和CO,平衡________移动。
②CO体积分数为40%时,CO2的转化率为_______。
③已知:气体分压(p分)=气体总压×体积分数。800℃时用平衡分压代替平衡浓度表示平衡常数Kp=______(用含p总的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cr、Fe、Ni单质及化合物有重要的用途。
(1)用Cr2O3作原料,铝粉作还原剂的铝热法是生产金属铬的主要方法之一,该反应是一个自发放热反应,由此可判断Cr—O键和Al—O键中____________键更强。研究发现气态氯化铝(Al2Cl6)是具有配位键的化合物,可溶于非极性溶剂,由此可知该分子是______(填“极性”或“非极性”)的。
(2)铁有α、γ、δ三种晶体构型,其中α-Fe单质为体心立方晶体,δ-Fe单质为简单立方晶体。则这两种晶体结构中铁原子的配位数之比是______。
(3)FeS2晶体的晶胞如下图所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3;晶胞中Fe2+位于S22—所形成的正八面体的体心,该正八面体的边长为______nm。

(4)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是__________。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为__________,提供孤电子对的成键原子是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应过程中发生物质变化的同时,常常伴有能量的变化.这种能量的变化常以热量的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等。
(1)下列△H表示物质燃烧热的是 ______ ;表示物质中和热的是 ______ (填“△H1”、“△H2”、“△H3”等).
A.2H2(g)+O2(g)═2H2O(l)△H1
B.C(s)+1/2O2(g)═CO(g)△H2
C.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H3
D.C(s)+O2(g)═CO2(g)△H4
E.C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l)△H5
F.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H6
G.2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O(l)△H7
H.CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l)△H8
(2)依据事实,写出下列反应的热化学方程式.
Ⅰ、在25℃、101kPa下,1gCH3OH燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为 _______________________;
Ⅱ、1.00L1.00mol/LH2SO4溶液与2.00L1.00mol/LNaOH溶液完全反应,放出114.6kJ的热量,表示其中和热的热化学方程式为 ________________________;
Ⅲ、已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、 946kJ,则N2与H2反应生成NH3的热化学方程式为 _______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com