
【题目】化学反应过程中发生物质变化的同时,常常伴有能量的变化.这种能量的变化常以热量的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等。
(1)下列△H表示物质燃烧热的是 ______ ;表示物质中和热的是 ______ (填“△H1”、“△H2”、“△H3”等).
A.2H2(g)+O2(g)═2H2O(l)△H1
B.C(s)+1/2O2(g)═CO(g)△H2
C.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H3
D.C(s)+O2(g)═CO2(g)△H4
E.C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l)△H5
F.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H6
G.2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O(l)△H7
H.CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l)△H8
(2)依据事实,写出下列反应的热化学方程式.
Ⅰ、在25℃、101kPa下,1gCH3OH燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为 _______________________;
Ⅱ、1.00L1.00mol/LH2SO4溶液与2.00L1.00mol/LNaOH溶液完全反应,放出114.6kJ的热量,表示其中和热的热化学方程式为 ________________________;
Ⅲ、已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、 946kJ,则N2与H2反应生成NH3的热化学方程式为 _______________________。
【答案】△H4△H5△H6CH3OH(l)+3/2O2(g)==CO2(g)+2H2O(l) △H= -725.76 kJ/mol1/2H2SO4(aq)+NaOH(aq)==H2O(l)+1/2Na2SO4(aq) △H=-57.3kJ/molN2(g)+3H2(g)==2NH3(g ) △H=-92kJ/mol
【解析】
(1)A.氢气的物质的量为2mol,反应热△H1不能表示燃烧热;B.碳燃烧的生成物为CO,不是稳定的氧化物CO2,反应热△H2不能表示燃烧热;C.1mol甲烷完全燃烧,生成的水是气态,不是稳定的状态,应为液态水,故反应热△H3不能表示燃烧热;D.C(s)+O2(g)═CO2(g)△H4中1molC完全燃烧生成二氧化碳,符合燃烧热概念,反应热△H4能表示燃烧热;E.C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l)△H5中1molC6H12O6完全燃烧生成二氧化碳与液态水,符合燃烧热概念,反应热△H5能表示燃烧热;F.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H6中实质是1mol氢离子与1mol氢氧根离子反应生成1molH2O,符合中和热概念,反应热△H6能表示中和热;G.反应生成的水为2mol,反应热△H7不能表示中和热;H.CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l)△H8是酸与碱反应生成1molH2O,符合中和热概念,反应热△H8能表示中和热;故答案为:△H4、△H5;△H6;
(2)Ⅰ、在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ.32g甲醇燃烧生成二氧化碳和液态水放出热量为725.76kJ;则表示甲醇燃烧热的热化学方程式为:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l)△H=-725.76kJmol-1,故答案为:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-725.76kJmol-1,故答案为:CH3OH(l)+ ![]() O2(g)=CO2(g)+2H2O(l) △H=-725.76kJmol-1;
O2(g)=CO2(g)+2H2O(l) △H=-725.76kJmol-1;
Ⅱ、1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,即生成2mol水放出114.6kJ的热量,反应的反应热为-11.46kJ/mol,中和热为-57.3kJ/mol,则中和热的热化学方程式:NaOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol,故答案为:NaOH(aq)+
Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol,故答案为:NaOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol;
Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol;
Ⅲ、在反应N2+3H22NH3中,断裂3molH-H键,1mol N≡N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的热量少,放出的热量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ,即N2(g)+3H2(g)=2NH3(g)△H=-92kJmol-1,故答案为:N2(g)+3H2(g)=2NH3(g)△H=-92kJmol-1。


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
【题目】下列化合物中的所有原子可能都在同一平面上的是
A.CH3(CH2)4CH3B.CH3CH2CHO
C.CH2=CHCH=CH2D.(CH3)3C-C≡C-CH=CHCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应中,水只做氧化剂的是
A.C+H2O=CO+H2
B.2H2O=2H2↑+O2↑
C.Na2O+H2O=2NaOH
D.CuO+H2=Cu+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 P、S、Cl 中,非金属性最强的是____________,原子半径最大的是____________,S的氢化物化学式是____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类生存和发展的重要支柱。根据要求回答下列问题。
(1)下列说法中错误的是______。

A.都是清洁能源
B.电能,H2属于二次能源,水力是一级能源
C.煤和石油属于化石燃料,燃烧会产生温室气体
D.氢能热值高,对环境无污染
(2)我国目前使用的主要能源是化石燃料,近年来我国能源总消费量与人均能源消费量如图。
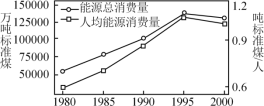
①在我国,煤的消费量巨大,且煤属于不可再生能源,寻找新能源是能源研究的主要课题之一。下列不属于新能源的是______。
A.太阳能 B.氢能 C.地热能 D.海洋能
E.生物质能 F.石油 G.天然气
②已知,1 kg煤大约放热2.9×104 kJ。风能能量巨大,地球上一年可利用的风能相当于5×1014 kw·h的电能。试计算,一年的风能若能全部利用,可相当于节省______吨燃煤。(已知,1 kw·h=3.6×103 kJ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标况下) | 50 | 120 | 232 | 290 | 310 |
⑴ 哪一时间段(指①0~1、②1~2、③2~3、④3~4、⑤4~5 min,下同)反应速率最大______ (填序号,下同),原因是_____________________________ 。
⑵ 哪一段时段的反应速率最小______,原因是________________________。
⑶ 求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变,不要求写出计算过程)_________________ 。
⑷ 如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液: A..蒸馏水 B.KNO3溶液 C. NaCl溶液 D.CuSO4溶液
你认为可行的是(填编号) _______________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质的方法正确的是( )
A.除去N2中的少量O2:通过灼热的CuO粉末
B.除去CO2中的少量HCl:通入NaOH溶液
C.除去KCl溶液中的少量K2CO3:加入适量的盐酸
D.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)![]() Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
A. 电池工作时,锌失去电子
B. 电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e﹣=Mn2O3(s)+2OH﹣(aq)
C. 电池工作时,电子由正极通过外电路流向负极
D. 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把分别盛有熔融的氯化钠、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钠、镁、铝的物质的量之比为( )
A.1︰2︰3B.3︰2︰1C.6︰3︰1D.6︰3︰2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com