
【题目】把分别盛有熔融的氯化钠、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钠、镁、铝的物质的量之比为( )
A.1︰2︰3B.3︰2︰1C.6︰3︰1D.6︰3︰2
科目:高中化学 来源: 题型:
【题目】化学反应过程中发生物质变化的同时,常常伴有能量的变化.这种能量的变化常以热量的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等。
(1)下列△H表示物质燃烧热的是 ______ ;表示物质中和热的是 ______ (填“△H1”、“△H2”、“△H3”等).
A.2H2(g)+O2(g)═2H2O(l)△H1
B.C(s)+1/2O2(g)═CO(g)△H2
C.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H3
D.C(s)+O2(g)═CO2(g)△H4
E.C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l)△H5
F.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H6
G.2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O(l)△H7
H.CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l)△H8
(2)依据事实,写出下列反应的热化学方程式.
Ⅰ、在25℃、101kPa下,1gCH3OH燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为 _______________________;
Ⅱ、1.00L1.00mol/LH2SO4溶液与2.00L1.00mol/LNaOH溶液完全反应,放出114.6kJ的热量,表示其中和热的热化学方程式为 ________________________;
Ⅲ、已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、 946kJ,则N2与H2反应生成NH3的热化学方程式为 _______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学习小组的同学拟用工业废铁屑(主要成分为Fe,还含有少量FeS、Fe3P等)制备FeSO4·7H2O,并探究FeSO4·7H2O高温分解的产物。

I.制备实验步骤如下:
①称取一定量的废铁屑,用热的碳酸钠溶液浸泡,再用蒸馏水洗涤。
②将处理后的废铁屑放入锥形瓶中,加入适量3mol·L-1的硫酸,连接好装置(如图)后水浴加热至反应完全。
③依据现象停止加热,趁热过滤,向滤液中补加少量硫酸。
④将滤液冷却、结晶、过滤、洗涤。
回答下列问题
(1)步骤①称量5.6g废铁屑时,若砝码与物品的位置放反了,则称得的废铁屑的质量会____ (填“增大”“减小”或“不变”)。
(2)步骤②中需控制硫酸的用量,使铁粉过量,其目的是_____________________。
(3)装置C的作用是__________________________。
(4)步骤④中洗涤时所用的洗涤剂最好是______(填标号)。
A.稀硝酸 B.无水乙醇 C.苯
(5)测定产品的纯度:
称取mg产品,放入锥形瓶中,用经煮沸过且冷却的蒸馏水和稀硫酸溶解,然后用cmol·L-1的KMnO4标准溶液滴定,消耗VmLKMnO4标准溶液。
蒸馏水煮沸的原因:______________,KMnO4标准溶液用______(酸或碱)式滴定管,产品的纯度为_______(列出计算表达式即可)。
Ⅱ.探究FeSO4·7H2O高温分解的产物的实验装置及步骤如下,请完成相关填空:
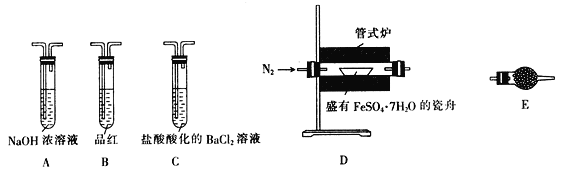
操作步骤 | 实验现象 | 解释原因 |
组装好仪器,先充入氮气,再加热管式炉至700℃一段时间 | 试管E中的白色固体变蓝 | 分解得到的产物中含水蒸气 |
气体产物经过试管B时 | 品红溶液褪色 | (6) 产物中含有 _________________ |
气体产物经过试管C时 | 试管C中出现白色沉淀 | (7)C中反应的化学方程式为 ___________________________ |
将瓷舟中反应后的固体溶于足量稀硫酸,再滴入几滴KSCN溶液 | (8)____________________ | (9) 溶液中含有 _______________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对塑料的叙述不正确的是 ( )
A.热塑性塑料具有长链状的线型结构
B.热固性塑料在形成初期是长链状的
C.热固性塑料链与链之间会形成共价键,产生一些交联
D.热固性塑料在高温时共价键也不断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石的主要成分是Cu2(OH)2CO3(含Fe2O3、FeCO3、Al2O3、SiO2杂质),工业上用孔雀石制备硫酸铜的第一步需用过量的硫酸溶解并过滤。常温下,分别取滤液并向其中加入指定物质,反应后的溶液中大量存在的离子组正确的是
A. 加入过量氨水:Fe3+、NH4+、SO42-、OH-
B. 加入过量NaClO溶液:Fe2+、Na+、ClO-、SO42-
C. 加入过量NaOH溶液:Na+、AlO2-、SO42-、OH-
D. 加入过量NaHCO3溶液:Na+、Al3+、SO42-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下图所示:
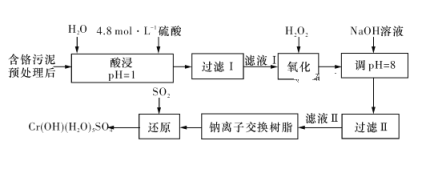
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L-1的浓硫酸配制240 mL 4.8 mol·L-1的硫酸溶液,需量取浓硫酸__________mL;配制时所用玻璃仪器除量筒、烧杯、胶头滴管和玻璃棒外,还需____________。
(2)“酸浸”时,为了提高浸取率可采取的措施有__________________。
(3)H2O2的作用是将“滤液Ⅰ”中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:___________________。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | — | — | — |
沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-。过滤后“滤液Ⅱ”中的阳离子主要有Na+、Ca2+、Mg2+,但溶液的pH不能超过8,其理由是__________________。
(5)钠离子交换树脂的反应原理为Mn++nNaR===MRn+nNa+,利用钠离子交换树脂除去“滤液Ⅱ”中的金属阳离子是________(填离子符号)。
(6)写出上述流程中用SO2进行还原时发生反应的化学方程式:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2 和 Cl2 反应的微观过程可用右图表示,下列有关说法正确的是
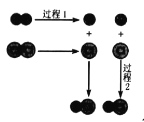
A. 过程 1 释放能量B. 过程 2 吸收能量
C. 该反应为吸热反应D. 反应物总能量高于生成物总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表中位于金属和非金属元素交界处最容易找到的材料是( )
A.半导体材料B.制催化剂的材料
C.制农药的材料D.耐高温、耐腐蚀的合金材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com