
【题目】某校学习小组的同学拟用工业废铁屑(主要成分为Fe,还含有少量FeS、Fe3P等)制备FeSO4·7H2O,并探究FeSO4·7H2O高温分解的产物。

I.制备实验步骤如下:
①称取一定量的废铁屑,用热的碳酸钠溶液浸泡,再用蒸馏水洗涤。
②将处理后的废铁屑放入锥形瓶中,加入适量3mol·L-1的硫酸,连接好装置(如图)后水浴加热至反应完全。
③依据现象停止加热,趁热过滤,向滤液中补加少量硫酸。
④将滤液冷却、结晶、过滤、洗涤。
回答下列问题
(1)步骤①称量5.6g废铁屑时,若砝码与物品的位置放反了,则称得的废铁屑的质量会____ (填“增大”“减小”或“不变”)。
(2)步骤②中需控制硫酸的用量,使铁粉过量,其目的是_____________________。
(3)装置C的作用是__________________________。
(4)步骤④中洗涤时所用的洗涤剂最好是______(填标号)。
A.稀硝酸 B.无水乙醇 C.苯
(5)测定产品的纯度:
称取mg产品,放入锥形瓶中,用经煮沸过且冷却的蒸馏水和稀硫酸溶解,然后用cmol·L-1的KMnO4标准溶液滴定,消耗VmLKMnO4标准溶液。
蒸馏水煮沸的原因:______________,KMnO4标准溶液用______(酸或碱)式滴定管,产品的纯度为_______(列出计算表达式即可)。
Ⅱ.探究FeSO4·7H2O高温分解的产物的实验装置及步骤如下,请完成相关填空:
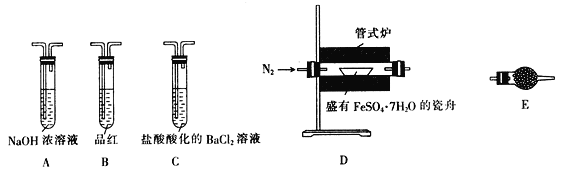
操作步骤 | 实验现象 | 解释原因 |
组装好仪器,先充入氮气,再加热管式炉至700℃一段时间 | 试管E中的白色固体变蓝 | 分解得到的产物中含水蒸气 |
气体产物经过试管B时 | 品红溶液褪色 | (6) 产物中含有 _________________ |
气体产物经过试管C时 | 试管C中出现白色沉淀 | (7)C中反应的化学方程式为 ___________________________ |
将瓷舟中反应后的固体溶于足量稀硫酸,再滴入几滴KSCN溶液 | (8)____________________ | (9) 溶液中含有 _______________ |
【答案】减小 保证溶液中都是Fe2+ 除去H2S、PH3等杂质 B 除去蒸馏水中的氧气 酸 ![]() 二氧化硫 SO3+H2O+BaCl2=BaSO4↓+2HCl 溶液变成血红色 溶液含有Fe3+
二氧化硫 SO3+H2O+BaCl2=BaSO4↓+2HCl 溶液变成血红色 溶液含有Fe3+
【解析】
根据亚铁离子和三价铁离子的性质及转化关系分析解答;根据化学实验基础操作及注意事项分析解答;根据酸碱滴定实验操作及注意事项分析解答;
(1)左物右码时,称量物品的质量是砝码加游码,即5g(砝码)+0.6g(游码),当药品放错盘时,即得到5g-0.6g=4.4g,故砝码与物品的位置放反了,则称得的废铁屑的质量会偏小,故答案为:偏小;
(2)反应过程生成的Fe2+在空气中易被氧化成Fe3+,所以需要Fe过量,可以避免生成Fe3+,故答案为:保证溶液中都是Fe2+;
(3)由于铁粉中含有的少量FeS、Fe3P与硫酸反应生成H2S、PH3气体,不能直接排放在空气中,故用硫酸铜溶液进行尾气处理,故答案为:除去H2S、PH3等杂质;
(4) 硝酸具有强氧化性,可将Fe2+氧化成Fe3+;无水乙醇可以除去晶体表面附着的硫酸等杂质,同时能降低FeSO4在水中的溶解度,减少FeSO47H2O的损耗;苯难以除去晶体表面附着的杂质,同时苯有毒;故B正确;
(5)将蒸馏水煮沸,是为了除去水中的氧气,由于KMnO4具有强氧化性,能够腐蚀碱式滴定管的橡胶管,故应选用酸式滴定管盛装,根据方程式:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O可知5Fe2+~MnO4-,即n(Fe2+)=5n(MnO4-)=![]() mol,m(FeSO4·7H2O)=
mol,m(FeSO4·7H2O)=![]() g,故药品纯度为:
g,故药品纯度为:![]() ;
;
Ⅱ.能使品红溶液褪色的气体是SO2,说明加热FeSO4·7H2O时有SO2气体生成,经过C装置时,生成了白色沉淀说明该沉淀是BaSO4,即反应方程式为:SO3+H2O+BaCl2=BaSO4↓+2HCl,加热的过程中,Fe2+被氧化生成Fe3+,故将瓷舟中反应后的固体溶于足量稀硫酸,再滴入几滴KSCN溶液,溶液变成血红色,说明溶液含有Fe3+;
故答案为:二氧化硫,SO3+H2O+BaCl2=BaSO4↓+2HCl,溶液变成血红色 , 溶液含有Fe3+。


 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:
【题目】下列各反应中,水只做氧化剂的是
A.C+H2O=CO+H2
B.2H2O=2H2↑+O2↑
C.Na2O+H2O=2NaOH
D.CuO+H2=Cu+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质的方法正确的是( )
A.除去N2中的少量O2:通过灼热的CuO粉末
B.除去CO2中的少量HCl:通入NaOH溶液
C.除去KCl溶液中的少量K2CO3:加入适量的盐酸
D.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)![]() Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
A. 电池工作时,锌失去电子
B. 电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e﹣=Mn2O3(s)+2OH﹣(aq)
C. 电池工作时,电子由正极通过外电路流向负极
D. 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列仪器能直接用酒精灯加热的是
①量筒 ②表面皿 ③烧杯 ④试管 ⑤容量瓶 ⑥蒸发皿 ⑦烧瓶
A. ②③④⑥⑦ B. ③⑥ C. ④⑥ D. ④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL0.5mol·L-1的盐酸与50mL0.55mol·L-1的NaOH溶液在下图所示的位置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
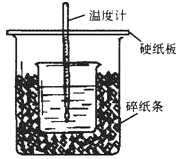
(1)从实验装置上看,图中尚缺少的一种玻璃用品是__________。
(2)烧杯间填满碎纸条的作用是____________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值____(填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等、不相等”),所求中和热__________(填“相等、不相等”),简述理由___________
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会______________;(填“偏大”、“偏小”、“无影响”)。
(6)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)═N2O4(l) △H1═-19.5kJmol-1
②N2H4(l)+O2(g)═N2(g)+2H2O(g) △H2═-534.2kJmol-1
写出肼和N2O4反应的热化学方程式________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同情况下测得A(g)+3B(g)![]() 2C(g)+2D(g)的下列反应速率,其中反应速率最大的是
2C(g)+2D(g)的下列反应速率,其中反应速率最大的是
A. υ(D)=0.01 molL-1s-1 B. υ(C)=0.5 molL-1min-1
C. υ(B)=0.6 molL-1min-1 D. υ(A)=0.2molL-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把分别盛有熔融的氯化钠、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钠、镁、铝的物质的量之比为( )
A.1︰2︰3B.3︰2︰1C.6︰3︰1D.6︰3︰2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是一种常见化学电源,其原理反应:2H2+O2=2H2O,其工作示意图如图。下列说法不正确的是
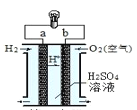
A. a 极是负极
B. b 电极上发生还原反应
C. 正极的电极反应式为:O2+2H2O+4e-=OH-
D. 放电前后电解质溶液的pH发生改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com