
【题目】50mL0.5mol·L-1的盐酸与50mL0.55mol·L-1的NaOH溶液在下图所示的位置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
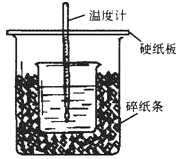
(1)从实验装置上看,图中尚缺少的一种玻璃用品是__________。
(2)烧杯间填满碎纸条的作用是____________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值____(填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等、不相等”),所求中和热__________(填“相等、不相等”),简述理由___________
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会______________;(填“偏大”、“偏小”、“无影响”)。
(6)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)═N2O4(l) △H1═-19.5kJmol-1
②N2H4(l)+O2(g)═N2(g)+2H2O(g) △H2═-534.2kJmol-1
写出肼和N2O4反应的热化学方程式________ 。
【答案】环形玻璃搅拌棒减少实验过程中的热量损失偏小不相等相等因为中和热是指酸碱中和反应生成1mol水所放出的热量,与酸碱用量无关偏小2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △H=-1048.9kJ/mol
【解析】
(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器;
(2)中和热测定实验成败的关键是保温措施,大小烧杯之间填满碎纸条的作用是:减少实验过程中的热量损失;
(3)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小;
(4)反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL0.25mol·L﹣1H2SO4溶液跟50mL0.55mol·L﹣1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所测得中和热数值相等;
(5)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ,故偏小;
(6)①N2(g)+2O2(g)═N2O4(l) △H1═-19.5kJmol-1
②N2H4(l)+O2(g)═N2(g)+2H2O(g) △H2═-534.2kJmol-1
根据盖斯定律得出肼和N2O4反应的热化学方程:②×2-①得到: 2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g),△H=△H2×2-△H1=-1048.9kJ/mol.


科目:高中化学 来源: 题型:
【题目】海水提镁的主要流程如下,下列说法正确的是

①试剂M是盐酸 ②流程中的反应全部都是非氧化还原反应
③操作b只是过滤 ④用海水晒盐后的饱和溶液加石灰乳制Mg(OH)2
⑤采用电解法冶炼镁是因为镁很活泼
A. ①②③④⑤ B. ②③ C. ④⑤ D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷的单质和化合物在科研与生产中有许多重要用途,铜及其合金是人类最早使用的金属材料。请回答下列问题:
(1)白磷是磷的一种单质,其分子结构如图所示,则一个分子中有____对成键电子对和____对孤电子对。

(2)N和P都有+5价,PCl5能形成离子型晶体,晶格中含有[PCl4]+和[PCl6]-,则[PCl4]+空间构型为______。
(3)电负性比较:P_____S(填“>”“=”“<”);而P的第一电离能比S大的原因是______。
(4)铜及其合金是人类最早使用的金属材料,Cu2+能与NH3形成配位数为4的配合物[Cu(NH3)4]SO4。
①铜元素在周期表中的位置是__________ ,1mol[Cu(NH3)4]SO4 有___mol配位键 ;②[Cu(NH3)4]SO4中,存在的化学键的类型有_____(填标号)。
A.离子键 B.金属键 C.配位键 D.非极性键 E.极性键
(5)磷化镓(GaP)材料是研制微电子器件、光电子器件的新型半导体材料。GaP的晶体结构是闪锌矿型结构(如图所示),晶胞参数apm。
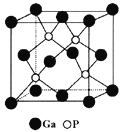
①与Ga紧邻的P个数为________。
②GaP晶体的密度为(列出计算式) ______g·cm-3(NA为阿伏加德罗常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学习小组的同学拟用工业废铁屑(主要成分为Fe,还含有少量FeS、Fe3P等)制备FeSO4·7H2O,并探究FeSO4·7H2O高温分解的产物。

I.制备实验步骤如下:
①称取一定量的废铁屑,用热的碳酸钠溶液浸泡,再用蒸馏水洗涤。
②将处理后的废铁屑放入锥形瓶中,加入适量3mol·L-1的硫酸,连接好装置(如图)后水浴加热至反应完全。
③依据现象停止加热,趁热过滤,向滤液中补加少量硫酸。
④将滤液冷却、结晶、过滤、洗涤。
回答下列问题
(1)步骤①称量5.6g废铁屑时,若砝码与物品的位置放反了,则称得的废铁屑的质量会____ (填“增大”“减小”或“不变”)。
(2)步骤②中需控制硫酸的用量,使铁粉过量,其目的是_____________________。
(3)装置C的作用是__________________________。
(4)步骤④中洗涤时所用的洗涤剂最好是______(填标号)。
A.稀硝酸 B.无水乙醇 C.苯
(5)测定产品的纯度:
称取mg产品,放入锥形瓶中,用经煮沸过且冷却的蒸馏水和稀硫酸溶解,然后用cmol·L-1的KMnO4标准溶液滴定,消耗VmLKMnO4标准溶液。
蒸馏水煮沸的原因:______________,KMnO4标准溶液用______(酸或碱)式滴定管,产品的纯度为_______(列出计算表达式即可)。
Ⅱ.探究FeSO4·7H2O高温分解的产物的实验装置及步骤如下,请完成相关填空:
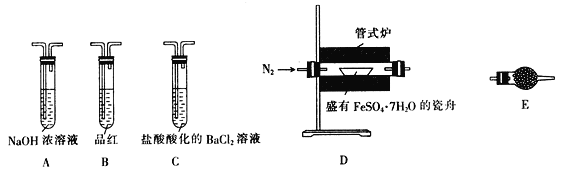
操作步骤 | 实验现象 | 解释原因 |
组装好仪器,先充入氮气,再加热管式炉至700℃一段时间 | 试管E中的白色固体变蓝 | 分解得到的产物中含水蒸气 |
气体产物经过试管B时 | 品红溶液褪色 | (6) 产物中含有 _________________ |
气体产物经过试管C时 | 试管C中出现白色沉淀 | (7)C中反应的化学方程式为 ___________________________ |
将瓷舟中反应后的固体溶于足量稀硫酸,再滴入几滴KSCN溶液 | (8)____________________ | (9) 溶液中含有 _______________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最新发现的第113号、115号、117号和118号元素已正式写入元素周期表。根据物质结构、元素周期律的知识,下列说法正确的是( )
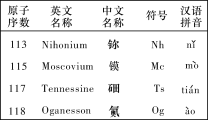
A. Nh(OH)3具有两性
B. Mc位于元素周期表中第七周期第ⅤA族,其原子半径小于Ts
C. Og是一种人工合成的稀有气体元素,在元素周期表中位于第七周期0族
D. 若制得Ts的最高价氧化物对应的水化物,其酸性强于HClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对塑料的叙述不正确的是 ( )
A.热塑性塑料具有长链状的线型结构
B.热固性塑料在形成初期是长链状的
C.热固性塑料链与链之间会形成共价键,产生一些交联
D.热固性塑料在高温时共价键也不断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下图所示:
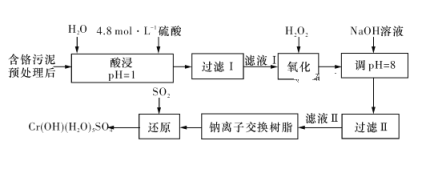
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L-1的浓硫酸配制240 mL 4.8 mol·L-1的硫酸溶液,需量取浓硫酸__________mL;配制时所用玻璃仪器除量筒、烧杯、胶头滴管和玻璃棒外,还需____________。
(2)“酸浸”时,为了提高浸取率可采取的措施有__________________。
(3)H2O2的作用是将“滤液Ⅰ”中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:___________________。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | — | — | — |
沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-。过滤后“滤液Ⅱ”中的阳离子主要有Na+、Ca2+、Mg2+,但溶液的pH不能超过8,其理由是__________________。
(5)钠离子交换树脂的反应原理为Mn++nNaR===MRn+nNa+,利用钠离子交换树脂除去“滤液Ⅱ”中的金属阳离子是________(填离子符号)。
(6)写出上述流程中用SO2进行还原时发生反应的化学方程式:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 同温同压下甲烷和氧气的密度之比为2∶1
B. 1 g甲烷和1 g氧气的原子数之比为5∶1
C. 等物质的量的甲烷和氧气的质量之比为2∶1
D. 在标准状况下等质量的甲烷和氧气的体积之比为1∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com