
【题目】磷的单质和化合物在科研与生产中有许多重要用途,铜及其合金是人类最早使用的金属材料。请回答下列问题:
(1)白磷是磷的一种单质,其分子结构如图所示,则一个分子中有____对成键电子对和____对孤电子对。

(2)N和P都有+5价,PCl5能形成离子型晶体,晶格中含有[PCl4]+和[PCl6]-,则[PCl4]+空间构型为______。
(3)电负性比较:P_____S(填“>”“=”“<”);而P的第一电离能比S大的原因是______。
(4)铜及其合金是人类最早使用的金属材料,Cu2+能与NH3形成配位数为4的配合物[Cu(NH3)4]SO4。
①铜元素在周期表中的位置是__________ ,1mol[Cu(NH3)4]SO4 有___mol配位键 ;②[Cu(NH3)4]SO4中,存在的化学键的类型有_____(填标号)。
A.离子键 B.金属键 C.配位键 D.非极性键 E.极性键
(5)磷化镓(GaP)材料是研制微电子器件、光电子器件的新型半导体材料。GaP的晶体结构是闪锌矿型结构(如图所示),晶胞参数apm。
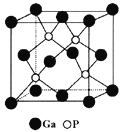
①与Ga紧邻的P个数为________。
②GaP晶体的密度为(列出计算式) ______g·cm-3(NA为阿伏加德罗常数)。
【答案】6 4 正四面体形 < P原子的3p3为半充满状态,较稳定 第四周期ⅠB族 4 ACE 4 ![]()
【解析】
根据白磷的分子结构和核外电子排布情况分析分子中的成键情况;根据价层电子对互斥理论分析分子的空间构型;根据晶胞的结构特点计算晶胞的密度。
(1)根据白磷分子结构可知,P最外层有5个电子,4个P原子形成了正四面体结构,有六对成键电子对,4对孤电子对;
(2)PCl4+中P原子含有的孤对电子对数=![]() =0,即不存在孤电子对,由于P原子的价层电子对数是4,所以空间构型是正四面体;
=0,即不存在孤电子对,由于P原子的价层电子对数是4,所以空间构型是正四面体;
(3)元素的非金属性越强,电负性越大,所以电负性:P<S,由于P原子的核外电子排布:[Ne]3s23p3,其中3p3轨道是半满状态,比较稳定,故P的第一电离能比S大;
(4) ① Cu元素原子核外电子数为29,外围电子排布式为3d104s1,则铜位于第四周期第IB族元素; [Cu(NH3)4]SO4 中铜离子提供空轨道,氮原子提供孤电子对,故1mol[Cu(NH3)4]SO4 有4mol配位键,;②[Cu(NH3)4]SO4中Cu2+与NH3之间的化学键为配位键,N-H为极性共价键, [Cu(NH3)4]2+与SO42-之间是离子键,故答案选ACE;
(5) 与Ga紧邻的P个数为4个,从该晶胞的结构可知,一个晶胞中含有Ga原子的数目:8![]() +6
+6![]() =4个,P原子个数为:4,晶胞的体积为:(a
=4个,P原子个数为:4,晶胞的体积为:(a![]() )3cm3,晶胞的密度为:
)3cm3,晶胞的密度为:![]() ;故答案为: 4 ,
;故答案为: 4 , ![]() 。
。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
【题目】甲、乙是元素周期表中同一主族的两种元素,若甲的原子序数为 x,则乙的原子序数不可能是
A. x﹣2 B. x+4 C. x+8 D. x+18
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标况下) | 50 | 120 | 232 | 290 | 310 |
⑴ 哪一时间段(指①0~1、②1~2、③2~3、④3~4、⑤4~5 min,下同)反应速率最大______ (填序号,下同),原因是_____________________________ 。
⑵ 哪一段时段的反应速率最小______,原因是________________________。
⑶ 求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变,不要求写出计算过程)_________________ 。
⑷ 如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液: A..蒸馏水 B.KNO3溶液 C. NaCl溶液 D.CuSO4溶液
你认为可行的是(填编号) _______________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A原子核内只有1个质子;B原子半径是其所在主族中最小的,B的最高价氧化物对应的水化物的化学式为HBO3;C原子最外层的电子数比次外层的多4;C的简单阴离子与D的阳离子具有相同的电子层结构,两元素可形成化合物D2C;C、E同主族。回答下列问题:
(1)B在元素周期表中的位置为______________________。
(2)E的氧化物对应的水化物有______________________ (写化学式)。
(3)B、C、D、E形成的简单离子半径由大到小的关系是______________________(用离子符号表示)。
(4)化合物D2C的形成过程为______________________(用电子式表示)。
(5)由A、B、C三种元素形成的常见的离子化合物的化学式为___________,该化合物的水溶液与强碱溶液共热发生反应的离子方程式为______________________。
(6)化合物D2EC3在一定条件下可以发生分解反应生成两种盐,其中一种产物为无氧酸盐,则此反应的化学方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)![]() Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
A. 电池工作时,锌失去电子
B. 电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e﹣=Mn2O3(s)+2OH﹣(aq)
C. 电池工作时,电子由正极通过外电路流向负极
D. 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时N电极的质量减少,请回答下列问题:
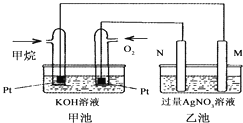
(1)M电极的材料是________,其电极反应式为:________N的电极名称是________,电极反应式为:________
(2)通入甲烷的铂电极的电极反应式为________.
(3)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为________ L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL0.5mol·L-1的盐酸与50mL0.55mol·L-1的NaOH溶液在下图所示的位置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
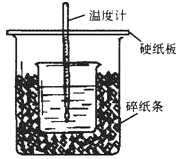
(1)从实验装置上看,图中尚缺少的一种玻璃用品是__________。
(2)烧杯间填满碎纸条的作用是____________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值____(填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等、不相等”),所求中和热__________(填“相等、不相等”),简述理由___________
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会______________;(填“偏大”、“偏小”、“无影响”)。
(6)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)═N2O4(l) △H1═-19.5kJmol-1
②N2H4(l)+O2(g)═N2(g)+2H2O(g) △H2═-534.2kJmol-1
写出肼和N2O4反应的热化学方程式________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种合成某药物中间体Z的方法如下,下列说法正确的是( )
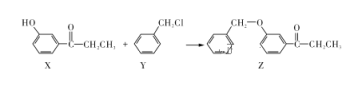
A. 1 mol X最多能消耗溴水中的2 mol Br2
B. Y可以发生消去反应
C. Y中所有原子可以在同一平面
D. 用FeCl3溶液可以检验Z中是否混有X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是( )
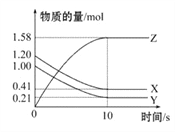
A. 反应开始到10 s,用Z表示的反应速率为0.158 mol·L-1·s-1
B. 10 s后,该反应停止进行
C. 反应的化学方程式为2X(g)+Y(g)![]() 2Z(g)
2Z(g)
D. 0~10 s的时间内的平均反应速率:v(X)=v(Y)=0.0395 mol·L-1·s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com