
【题目】一种合成某药物中间体Z的方法如下,下列说法正确的是( )
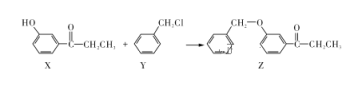
A. 1 mol X最多能消耗溴水中的2 mol Br2
B. Y可以发生消去反应
C. Y中所有原子可以在同一平面
D. 用FeCl3溶液可以检验Z中是否混有X
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W代表四种短周期元素,有关它们的部分结构信息及性质信息如表所示。
元素 | 部分结构信息 | 部分性质信息 |
X | X的单质由双原子分子构成 | X的氢化物水溶液呈碱性 |
Y | Y原子的最外层电子数是其内层电子数的两倍 | Y能形成多种气态氢化物 |
Z | Z原子有三个电子层 | 含有Z元素的化合物的焰色反应呈黄色 |
W | W原子的最外层电子数等于(2n+1)(n为原子核外电子层数) | W和Z能按1∶1的原子个数比形成离子化合物 |
请按要求回答下列问题:
(1)W在元素周期表中的位置是______。
(2)X简单气态氢化物的分子式为______。(用化学式表示)
(3)X、Y、W三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是______。(用化学式表示)
(4)Z单质在W单质中发生反应的实验现象是______。
(5)写出W的单质与二氧化硫的混合气体通入水中所发生反应的离子方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷的单质和化合物在科研与生产中有许多重要用途,铜及其合金是人类最早使用的金属材料。请回答下列问题:
(1)白磷是磷的一种单质,其分子结构如图所示,则一个分子中有____对成键电子对和____对孤电子对。

(2)N和P都有+5价,PCl5能形成离子型晶体,晶格中含有[PCl4]+和[PCl6]-,则[PCl4]+空间构型为______。
(3)电负性比较:P_____S(填“>”“=”“<”);而P的第一电离能比S大的原因是______。
(4)铜及其合金是人类最早使用的金属材料,Cu2+能与NH3形成配位数为4的配合物[Cu(NH3)4]SO4。
①铜元素在周期表中的位置是__________ ,1mol[Cu(NH3)4]SO4 有___mol配位键 ;②[Cu(NH3)4]SO4中,存在的化学键的类型有_____(填标号)。
A.离子键 B.金属键 C.配位键 D.非极性键 E.极性键
(5)磷化镓(GaP)材料是研制微电子器件、光电子器件的新型半导体材料。GaP的晶体结构是闪锌矿型结构(如图所示),晶胞参数apm。
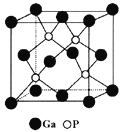
①与Ga紧邻的P个数为________。
②GaP晶体的密度为(列出计算式) ______g·cm-3(NA为阿伏加德罗常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最新发现的第113号、115号、117号和118号元素已正式写入元素周期表。根据物质结构、元素周期律的知识,下列说法正确的是( )
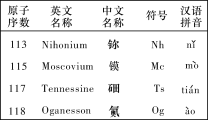
A. Nh(OH)3具有两性
B. Mc位于元素周期表中第七周期第ⅤA族,其原子半径小于Ts
C. Og是一种人工合成的稀有气体元素,在元素周期表中位于第七周期0族
D. 若制得Ts的最高价氧化物对应的水化物,其酸性强于HClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对塑料的叙述不正确的是 ( )
A.热塑性塑料具有长链状的线型结构
B.热固性塑料在形成初期是长链状的
C.热固性塑料链与链之间会形成共价键,产生一些交联
D.热固性塑料在高温时共价键也不断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把下列现象中硫酸所表现出来的性质填写在空白处:
(1)把锌粒放入稀硫酸中时,有气体放出 _____________;
(2)盛有浓硫酸的烧杯敞口放置一段时间后,质量增加 _____________;
(3)用玻璃棒蘸浓硫酸滴在纸上时,纸变黑 _____________;
(4)把木炭放入热的浓硫酸中时,有气体放出 _____________;
(5)在常温下可以用铁、铝制容器盛装冷的浓硫酸 _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下图所示:
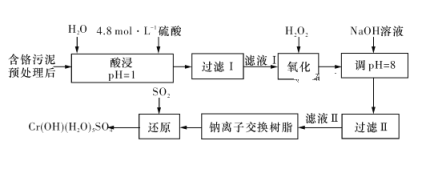
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L-1的浓硫酸配制240 mL 4.8 mol·L-1的硫酸溶液,需量取浓硫酸__________mL;配制时所用玻璃仪器除量筒、烧杯、胶头滴管和玻璃棒外,还需____________。
(2)“酸浸”时,为了提高浸取率可采取的措施有__________________。
(3)H2O2的作用是将“滤液Ⅰ”中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:___________________。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | — | — | — |
沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-。过滤后“滤液Ⅱ”中的阳离子主要有Na+、Ca2+、Mg2+,但溶液的pH不能超过8,其理由是__________________。
(5)钠离子交换树脂的反应原理为Mn++nNaR===MRn+nNa+,利用钠离子交换树脂除去“滤液Ⅱ”中的金属阳离子是________(填离子符号)。
(6)写出上述流程中用SO2进行还原时发生反应的化学方程式:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一) 某实验小组的同学们用下列装置进行乙醇催化氧化的实验.(部分夹持仪器已略去)已知:乙醇的沸点为 78℃,易溶于水;乙醛的沸点为 20.8℃,易溶于水。
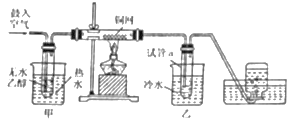
(1) 乙醇催化氧化的化学方程是_________。
(2)装置甲中热水的主要作用是_________。
(3)装置乙中冷水的主要作用是_________,其温度要求是_________,为达到该温度,可进行的操作是_________。
(4)实验开始前,加热铜网,观察到的现象是_________,该反应的化学方程式是_________;鼓入空气和乙醇蒸气后,铜网处观察到的现象是_________,此反应中,铜的作用是_________。
(5) 在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该反应_________(填“吸热”或“放热”);集气瓶中收集到的气体的主要成分是_________。
(6)实验结束后,取出装置乙中的试管,打开橡胶塞,能闻到_________。
(二) 化学兴趣小组的同学们设计了如下装置验证乙醇催化氧化的产物(加热仪器、夹持装置已略
去)。
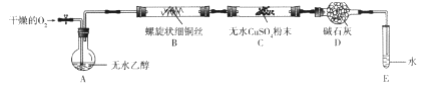
已知: 乙醇的沸点为 78℃, 易溶于水; 乙醛的沸点为 20.8℃, 易溶于水。
(1)乙醇催化氧化的化学方程式是___________。
(2)实验时上述装置中需要加热的是__________(填字母,下同),其中应该先加热的是_______, 为使装置A中的乙醇成为蒸气, 最简单的加热方法是_________。
(3)实验室制取氧气的化学方程式是___________。
(4)实验开始后,装置B中能观察到的现象是___________;装置C中能观察到的现象是__________, 由此得出的结论是_____________。
(5)装置 E 的作用是________, 能初步判定反应后有乙醛生成的依据是_____________。
(6)装置 D中的药品是__________, 其作用是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 在1 L0.1 mol/L的硫化钠溶液中,阴离子总数大于0.1NA
B. 常温常压下,Na2O2与足量H2O反应,生成4.48LO2,转移电子的数目为0.2NA
C. 在密闭容器中充入1.5 mol H2和0.5 mol N2,充分反应后可得到NH3的分子数为NA
D. 电解精炼铜的过程中,电路中每通过NA个电子,阳极溶解铜32g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com