
【题目】X、Y、Z、W代表四种短周期元素,有关它们的部分结构信息及性质信息如表所示。
元素 | 部分结构信息 | 部分性质信息 |
X | X的单质由双原子分子构成 | X的氢化物水溶液呈碱性 |
Y | Y原子的最外层电子数是其内层电子数的两倍 | Y能形成多种气态氢化物 |
Z | Z原子有三个电子层 | 含有Z元素的化合物的焰色反应呈黄色 |
W | W原子的最外层电子数等于(2n+1)(n为原子核外电子层数) | W和Z能按1∶1的原子个数比形成离子化合物 |
请按要求回答下列问题:
(1)W在元素周期表中的位置是______。
(2)X简单气态氢化物的分子式为______。(用化学式表示)
(3)X、Y、W三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是______。(用化学式表示)
(4)Z单质在W单质中发生反应的实验现象是______。
(5)写出W的单质与二氧化硫的混合气体通入水中所发生反应的离子方程式:______。
【答案】第三周期第ⅦA族 NH3 HClO4>HNO3>H2CO3 Na在Cl2中燃烧,有黄色的光,产生白烟 Cl2+SO2+2H2O ═ 4H++2Cl-+SO42-
【解析】
X、Y、Z、W是短周期的四种元素:X的单质由双原子分子构成,且X的氢化物水溶液呈碱性,故X为氮元素;Y原子的最外层电子数是其内层电子数的两倍,Y能形成多种气态氢化物,则Y为碳元素;Z元素的化合物的焰色反应呈黄色,且原子有三个电子层,故Z为钠元素;W原子的最外层电子数等于2n+1(n为原子核外电子层数),当n=2时,W为氮;当n=3时,W为氯。又因此W和钠能按1∶1的原子个数比形成离子化合物,则W为氯元素。故X为氮元素、Y为碳元素、Z为钠元素、W为氯元素。以此解题。
(1)W为氯元素,在元素周期表中的位置是第三周期第ⅦA族;
(2)X为氮元素,其简单气态氢化物的分子式为NH3;
(3) )最高价氧化物对应的水化物的酸性与元素的非金属性有关,非金属性越强,最高价氧化物对应的水化物的酸性越强,因此X、Y、W三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是HClO4>HNO3>H2CO3;
(4)钠单质在氯气中发生反应的原理为2Na+Cl2![]() 2NaCl,实验现象是Na在Cl2中燃烧,有黄色的光,产生白烟。
2NaCl,实验现象是Na在Cl2中燃烧,有黄色的光,产生白烟。
(5)氯气与二氧化硫的混合气体通入水中将发生氧化还原反应,该反应的离子方程式:Cl2+SO2+2H2O ═ 4H++2Cl-+SO42-。


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
【题目】如图所示。请回答:

(1)若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Zn,A极材料为铜,该装置能量转换形式____, A为____极,此电池所发生的反应化学方程式为_____,反应进行一段时间后溶液C中c(H+)将_____(填“变大” “变小”或“基本不变”)。溶液中的SO42-移向____极(填“A”或“B”)
(2)若C为CuSO4溶液,B电极材料为Fe,A极材料为石墨。则B为_____极,B极上电极反应属于____(填“氧化反应”或“还原反应”)。B电极上发生的电极反应式为______,A极产生的现象是_____;若AB两电极质量都为50.0g且反应过程中有0.2mol的电子发生转移,理论上AB两电极质量差为____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙是元素周期表中同一主族的两种元素,若甲的原子序数为 x,则乙的原子序数不可能是
A. x﹣2 B. x+4 C. x+8 D. x+18
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol
CO(g)+1/2O2(g)=CO2(g)△H=-282.9kJ/mol
某H2与CO的混合气体完全燃烧放出113.74kJ热量,同时生成3.6g液态水,则原混合气体中H2与CO的物质的量之比是( )
A. 1:1 B. 1:3 C. 1:4 D. 2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 P、S、Cl 中,非金属性最强的是____________,原子半径最大的是____________,S的氢化物化学式是____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO(g)与H2O(g)反应的能量变化如图所示,有关两者反应的说法正确的是( )

A. 该反应为吸热反应
B. 该反应不需要加热就能进行
C. 1 molCO(g)和1mol H2O(g)具有的总能量大于1 molCO2(g)和1 molH2(g)具有的总能量
D. 1 molCO2(g)和1 molH2(g)反应生成1 molCO(g)和1mol H2O(g)要放出41 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标况下) | 50 | 120 | 232 | 290 | 310 |
⑴ 哪一时间段(指①0~1、②1~2、③2~3、④3~4、⑤4~5 min,下同)反应速率最大______ (填序号,下同),原因是_____________________________ 。
⑵ 哪一段时段的反应速率最小______,原因是________________________。
⑶ 求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变,不要求写出计算过程)_________________ 。
⑷ 如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液: A..蒸馏水 B.KNO3溶液 C. NaCl溶液 D.CuSO4溶液
你认为可行的是(填编号) _______________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A原子核内只有1个质子;B原子半径是其所在主族中最小的,B的最高价氧化物对应的水化物的化学式为HBO3;C原子最外层的电子数比次外层的多4;C的简单阴离子与D的阳离子具有相同的电子层结构,两元素可形成化合物D2C;C、E同主族。回答下列问题:
(1)B在元素周期表中的位置为______________________。
(2)E的氧化物对应的水化物有______________________ (写化学式)。
(3)B、C、D、E形成的简单离子半径由大到小的关系是______________________(用离子符号表示)。
(4)化合物D2C的形成过程为______________________(用电子式表示)。
(5)由A、B、C三种元素形成的常见的离子化合物的化学式为___________,该化合物的水溶液与强碱溶液共热发生反应的离子方程式为______________________。
(6)化合物D2EC3在一定条件下可以发生分解反应生成两种盐,其中一种产物为无氧酸盐,则此反应的化学方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种合成某药物中间体Z的方法如下,下列说法正确的是( )
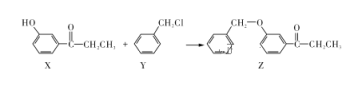
A. 1 mol X最多能消耗溴水中的2 mol Br2
B. Y可以发生消去反应
C. Y中所有原子可以在同一平面
D. 用FeCl3溶液可以检验Z中是否混有X
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com