
【题目】如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时N电极的质量减少,请回答下列问题:
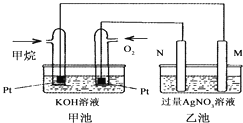
(1)M电极的材料是________,其电极反应式为:________N的电极名称是________,电极反应式为:________
(2)通入甲烷的铂电极的电极反应式为________.
(3)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为________ L(标准状况下)。
【答案】石墨Ag++e﹣→Ag阳极Fe﹣2e﹣═Fe2+CH4﹣8e﹣+10OH﹣=CO32﹣+7H2O0.224
【解析】
(1)碱性甲烷电池为原电池,通入甲烷的电极是负极,通入氧气的电极是正极,乙池有外接电源,属于电解池,根据图片知,工作时N电极的质量减少,所以N是阳极铁电极,电极反应为:Fe-2e-═Fe2+;M是阴极,是石墨电极,发生反应:Ag++e-→Ag;
(2)甲烷是燃料电池的负极,发生失电子的氧化反应,碱性环境下,电极反应式为:CH4-8e-+10OH-=CO32-+7H2O;
(3)n(Ag)=4.32g÷108g/mol=0.04mol,根据Ag++e-=Ag可以知道转移电子为0.04mol,甲池中通入氧气的一极为正极,反应式为2O2+8H++8e-=4H2O,则消耗n(O2)=1/4×0.04mol=0.01mol,V(O2)=0.01mol×22.4L/mol=0.224L。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1 173 K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是_______(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
(3)根据反应①与②可推导出K1、K2与K3之间的关系式为__________,据此关系式及上表数据,能推断出反应③是________(填“吸热”或“放热”)反应。
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有______ 、_____ (填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(5)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:

①图甲中t2时刻发生改变的条件是__________。
②图乙中t2时刻发生改变的条件是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究人员研制出一种可作为鱼雷和潜艇的储备电源的新型电池——锂水电池(结构如图),使用时加入水即可放电。下列关于该电池的说法不正确的是( )
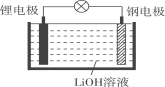
A. 锂为负极,钢为正极B. 工作时负极的电极反应式为Li-e-=Li+
C. 工作时OH-向钢电极移动D. 放电时电子的流向:锂电极→导线→钢电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:回答下列问题:
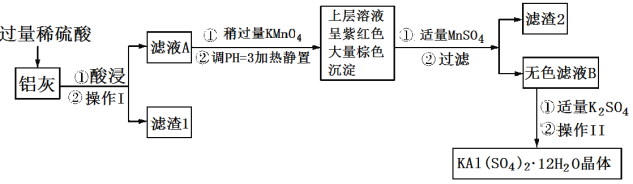
(1)明矾净水的原理是______________________________(用离子方程式表示)。
(2)操作Ⅰ是________,操作Ⅱ是蒸发浓缩、__________、过滤、__________、干燥。
(3)检验滤液A中是否存在Fe2+的试剂是________________(只用一种试剂)。
(4)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是_______________________,在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4—转化为Mn2+):________________。
(5)已知:在pH=3、加热条件下,MnO![]() 可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:________,滤渣2含有的物质是_______________。
可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:________,滤渣2含有的物质是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷的单质和化合物在科研与生产中有许多重要用途,铜及其合金是人类最早使用的金属材料。请回答下列问题:
(1)白磷是磷的一种单质,其分子结构如图所示,则一个分子中有____对成键电子对和____对孤电子对。

(2)N和P都有+5价,PCl5能形成离子型晶体,晶格中含有[PCl4]+和[PCl6]-,则[PCl4]+空间构型为______。
(3)电负性比较:P_____S(填“>”“=”“<”);而P的第一电离能比S大的原因是______。
(4)铜及其合金是人类最早使用的金属材料,Cu2+能与NH3形成配位数为4的配合物[Cu(NH3)4]SO4。
①铜元素在周期表中的位置是__________ ,1mol[Cu(NH3)4]SO4 有___mol配位键 ;②[Cu(NH3)4]SO4中,存在的化学键的类型有_____(填标号)。
A.离子键 B.金属键 C.配位键 D.非极性键 E.极性键
(5)磷化镓(GaP)材料是研制微电子器件、光电子器件的新型半导体材料。GaP的晶体结构是闪锌矿型结构(如图所示),晶胞参数apm。
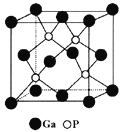
①与Ga紧邻的P个数为________。
②GaP晶体的密度为(列出计算式) ______g·cm-3(NA为阿伏加德罗常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生用如下图所示装置进行实验,以探究苯与溴发生反应的原理并分离提纯反应的产物。

请回答下列问题:
(1)实验开始时,关闭K2、开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。装置Ⅱ中生成有机物的反应为__________________________________________(填化学方程式),装置Ⅲ中小试管内苯的作用是__________________________________。
(2)能说明苯与液溴发生了取代反应的现象是_____________________。
(3)反应结束后,要让装置Ⅰ中的水倒吸入装置Ⅱ中,这样操作的目的是___________。简述这一操作的方法__________。
(4)将三颈烧瓶内反应后的液体依次进行下列实验操作就可得到较纯净的溴苯。
①用蒸馏水洗涤、振荡、分液;②用5%的NaOH溶液洗涤、振荡、分液;③用蒸馏水洗涤、振荡、分液;④加入无水CaCl2粉末干燥;⑤_______________(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最新发现的第113号、115号、117号和118号元素已正式写入元素周期表。根据物质结构、元素周期律的知识,下列说法正确的是( )
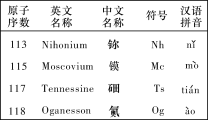
A. Nh(OH)3具有两性
B. Mc位于元素周期表中第七周期第ⅤA族,其原子半径小于Ts
C. Og是一种人工合成的稀有气体元素,在元素周期表中位于第七周期0族
D. 若制得Ts的最高价氧化物对应的水化物,其酸性强于HClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把下列现象中硫酸所表现出来的性质填写在空白处:
(1)把锌粒放入稀硫酸中时,有气体放出 _____________;
(2)盛有浓硫酸的烧杯敞口放置一段时间后,质量增加 _____________;
(3)用玻璃棒蘸浓硫酸滴在纸上时,纸变黑 _____________;
(4)把木炭放入热的浓硫酸中时,有气体放出 _____________;
(5)在常温下可以用铁、铝制容器盛装冷的浓硫酸 _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计实验探究NO与铜粉的反应并检验NO,实验装置如图所示(夹持装置略)。实验开始前,向装置中通入一段时间的N2,排尽装置内的空气。
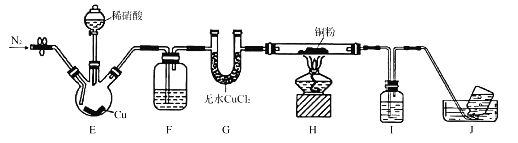
已知:在溶液中.FeSO4+NO![]() [Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法不正确的是
[Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法不正确的是
A. 装置B、E中的试剂依次为水、硫酸亚铁溶液
B. 若观察到装置D中红色粉末变黑色,则NO与Cu发生了反应
C. 实验结束后,先关闭分液漏斗的活塞,再熄灭酒精灯
D. 装置F收集的气体中可能含有NO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com