
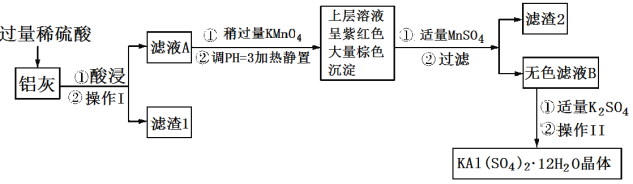
【题目】明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:回答下列问题:
(1)明矾净水的原理是______________________________(用离子方程式表示)。
(2)操作Ⅰ是________,操作Ⅱ是蒸发浓缩、__________、过滤、__________、干燥。
(3)检验滤液A中是否存在Fe2+的试剂是________________(只用一种试剂)。
(4)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是_______________________,在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4—转化为Mn2+):________________。
(5)已知:在pH=3、加热条件下,MnO![]() 可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:________,滤渣2含有的物质是_______________。
可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:________,滤渣2含有的物质是_______________。
【答案】Al3++3H2O![]() Al(OH)3(胶体)+3H+ 过滤 冷却结晶 洗涤 酸性高锰酸钾溶液(或铁氰化钾溶液) 2Al+2NaOH+2H2O=== 2NaAlO2+3H2↑ 5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O 3Mn2++2MnO4-+2H2O===5MnO2↓+4H+ MnO2、Fe(OH)3
Al(OH)3(胶体)+3H+ 过滤 冷却结晶 洗涤 酸性高锰酸钾溶液(或铁氰化钾溶液) 2Al+2NaOH+2H2O=== 2NaAlO2+3H2↑ 5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O 3Mn2++2MnO4-+2H2O===5MnO2↓+4H+ MnO2、Fe(OH)3
【解析】
铝灰(含Al、Al2O3及少量SiO2和FeOxFe2O3),加入过量稀硫酸酸溶过滤,滤液为硫酸铝、硫酸亚铁、硫酸铁,滤渣Ⅰ为二氧化硅,滤液A中加入稍过量高锰酸钾溶液氧化亚铁离子为铁离子,调节溶液pH使铁离子全部沉淀,铝离子不沉淀,加入适量硫酸锰除去过量的高锰酸钾过滤得到二氧化锰固体和氢氧化铁沉淀,滤液主要是硫酸铝溶液,加入硫酸钾蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到硫酸铝钾晶体;
(1)明矾净水是铝离子水解生成氢氧化铝具有吸附悬浮杂质的作用,反应的离子方程式为:Al3++3H2O![]() Al(OH)3(胶体)+3H+;
Al(OH)3(胶体)+3H+;
(2)固体和液体分离需要用过滤操作,操作Ⅰ是过滤,操作Ⅱ是溶液中得到晶体的方法,利用蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到明矾晶体;
(3)检验亚铁离子用高锰酸钾溶液或铁氰化钾溶液,滴入高锰酸钾溶液紫红色褪去,或加入铁氰化钾溶液会产生蓝色沉淀;
(4)将铝灰投入氢氧化钠溶液中反应生成氢气、偏铝酸钠,反应的化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑;酸性溶液中高锰酸钾溶液能氧化亚铁离子为铁离子,本身被还原为锰离子,反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,分析离子沉淀的pH范围,调节溶液pH=3,可以使使Fe3+转化成Fe(OH)3沉淀,并防止Al3+沉淀;故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,使Fe3+转化成Fe(OH)3沉淀,并防止Al3+沉淀;
(5)在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2。加入MnSO4发生反应,反应的离子方程式为:3Mn2++2MnO4-+2H2O=5MnO2↓+4H+;过滤得到反应中生成的难溶的二氧化锰沉淀和得到的氢氧化铁沉淀,答案为MnO2、Fe(OH)3。


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】二氧化碳气体可以用石灰石与稀盐酸反应制取,某同学在做该实验时,发现实验室中暂时没有稀盐酸,经过思考,他选择了稀硝酸。仅选择稀硝酸这一环节,该同学运用的方法是
A.实验法
B.比较法
C.观察法
D.分类法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液与足量的NaOH溶液反应: Ba2++HCO3-+OH-===BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合: 2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌和某浓度的HNO3反应时,若参加反应的锌与HNO3的物质的量之比为2:5,产物有硝酸锌、X和水,则X可能是( )
A. NO B. N2O C. N2O3 D. NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.苯和乙烯是两种重要的化工原料,都可用来衡量一个国家的化工水平
B.苯和乙烯都易燃烧,燃烧时火焰明亮产生黑烟
C.苯和乙烯都有毒,难溶于水,易溶于有机溶剂
D.苯主要来自于煤的干馏,乙烯主要来自于石油加工
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2具有强氧化性,可以用来漂白纺织类物品、麦杆、纤维等。
(1)如下图所示实验,反应的化学方程式为_______________。实验结束后,向试管所得溶液中滴加酚酞溶液,现象是___________________________。
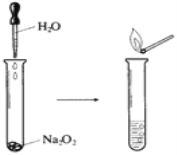
(2)若用嘴通过导管向附着少量Na2O2粉末的棉花吹气,棉花燃烧。原因是Na2O2与H2O和CO2反应,其中与CO2反应的化学方程式为______________________。若标准状况下反应生成了5.6LO2,则转移电子的物质的量为______mol。
过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:
①在NH4Cl溶液中加入Ca(OH)2;
②在第①步的生成的产物中加入30%H2O2,反应生成CaO28H2O沉淀;
③经过陈化、过滤,水洗得到CaO28H2O,再脱水干燥得到CaO2。
完成下列填空:
(3)第①步反应的化学方程式为_____________________。
(4)生产中可循环使用的物质是_____________________。
(5)检验CaO28H2O是否洗净的方法是___________。
(6)已知CaO2在350℃迅速分解生成CaO和O2。如图是实验室测定产品中CaO2含量的装置(夹持装置省略)。

若所取产品质量是m g,测得气体体积为V mL(标况),产品中CaO2的质量分数为________(用字母表示)。过氧化钙的含量也可用重量法测定,需要测定的物理量有______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示原电池工作时,右池中Y2O72-转化为Y3+。下列叙述正确的是( )

A. 左池电极反应式:X4+ + 2e- = X2+
B. 每消耗1mol Y2O72-,转移3mol电子
C. 左池中阴离子数目增加
D. 盐桥中阴离子移向右池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用下列装置和操作,能达到实验目的的是

A. 用装置甲分离出溴苯 B. 用装置乙验证乙炔的还原性
C. 用装置丙制取乙烯 D. 用装置丁制取乙酸乙酯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com