
【题目】下列描述的化学反应状态,不一定是平衡状态的是( )
A.H2(g)+Br2(g)![]() 2HBr(g),恒温、恒容下,反应体系中气体的颜色保持不变
2HBr(g),恒温、恒容下,反应体系中气体的颜色保持不变
B.2NO2(g) ![]() N2O4(g),恒温、恒容下,反应体系中气体的压强保持不变
N2O4(g),恒温、恒容下,反应体系中气体的压强保持不变
C.CaCO3(s) ![]() CO2(g)+CaO(s),恒温、恒容下,反应体系中气体的质量保持不变
CO2(g)+CaO(s),恒温、恒容下,反应体系中气体的质量保持不变
D.3H2(g)+N2(g) ![]() 2NH3(g),反应体系中H2与N2的物质的量之比保持3∶1
2NH3(g),反应体系中H2与N2的物质的量之比保持3∶1
【答案】D
【解析】
A.H2(g)+Br2(g) ![]() 2HBr(g) 恒温、恒容下,反应体系中气体的颜色保持不变,说明溴单质的浓度不再变化,达到了平衡,故A不符合题意;
2HBr(g) 恒温、恒容下,反应体系中气体的颜色保持不变,说明溴单质的浓度不再变化,达到了平衡,故A不符合题意;
B.2NO2(g) ![]() N2O4(g)是反应前后气体系数和不等的反应,当恒温、恒容下,反应体系中气体的压强保持不变,达到了平衡,故B不符合题意;
N2O4(g)是反应前后气体系数和不等的反应,当恒温、恒容下,反应体系中气体的压强保持不变,达到了平衡,故B不符合题意;
C.CaCO3(s) ![]() CO2(g)+CaO(s) 恒温、恒容下,随着反应的进行,气体质量会增大,当气体的质量保持不变,达到了平衡,故C不符合题意;
CO2(g)+CaO(s) 恒温、恒容下,随着反应的进行,气体质量会增大,当气体的质量保持不变,达到了平衡,故C不符合题意;
D.3H2(g)+N2(g) ![]() 2NH3(g) 反应体系中H2与N2的物质的量之比保持3:1,不能证明正逆反应速率相等,不一定是平衡状态,故D符合题意;
2NH3(g) 反应体系中H2与N2的物质的量之比保持3:1,不能证明正逆反应速率相等,不一定是平衡状态,故D符合题意;
答案为D。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】SO2、NO是大气污染物。吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
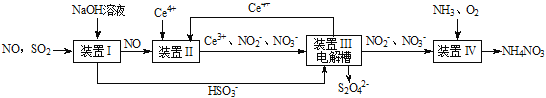
(1)装置Ⅰ中生成HSO3-的离子方程式为_____ 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。
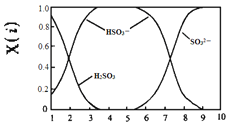
①下列说法正确的是_____(填字母序号)。
A.pH=8时,溶液中c(HSO3-) <c(SO32-)
B.pH=7时,溶液中c(Na+)=c(HSO3-)+c(SO32-)
C.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因:_____。
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出生成NO3-的离子方程式____。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如图所示。

①生成Ce4+的电极反应式为_________。
②生成Ce4+从电解槽的_____(填字母序号)口流出。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g/L,要使1m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2___L。(用含a代数式表示,计算结果保留整数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的()
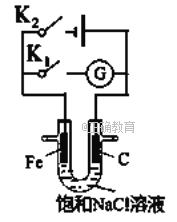
A. K1闭合,铁棒上发生的反应为2H++2e-=H2↑
B. K1闭合,石墨棒周围溶液碱性增强
C. K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D. K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(13分)硫酸铜晶体(CuSO4·5H2O)是铜盐中重要的无机化工原料,广泛应用于农业、电镀、饲料添加剂、催化剂、石油、选矿、油漆等行业。
Ⅰ.采用孔雀石[主要成分CuCO3·Cu(OH)2]、硫酸(70%)、氨水为原料制取硫酸铜晶体。其工艺流程如下:
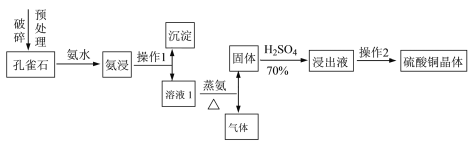
(1)预处理时要用破碎机将孔雀石破碎成粒子直径<1 mm,破碎的目的是____________________。
(2)已知氨浸时发生的反应为CuCO3·Cu(OH)2+8NH3·H2O![]() [Cu(NH3)4]2(OH)2CO3+8H2O,蒸氨时得到的固体呈黑色,请写出蒸氨时的反应方程式:______________________。
[Cu(NH3)4]2(OH)2CO3+8H2O,蒸氨时得到的固体呈黑色,请写出蒸氨时的反应方程式:______________________。
(3)蒸氨出来的气体有污染,需要净化处理,下图装置中合适的为___________(填标号);经吸收净化所得的溶液用途是_______________(任写一条)。

(4)操作2为一系列的操作,通过加热浓缩、冷却结晶、___________、洗涤、___________等操作得到硫酸铜晶体。
Ⅱ.采用金属铜单质制备硫酸铜晶体
(5)教材中用金属铜单质与浓硫酸反应制备硫酸铜,虽然生产工艺简洁,但在实际生产过程中不采用,其原因是______________________(任写两条)。
(6)某兴趣小组查阅资料得知:Cu+CuCl2![]() 2CuCl,4CuCl+O2+2H2O
2CuCl,4CuCl+O2+2H2O![]() 2[Cu(OH)2·CuCl2],[Cu(OH)2·CuCl2]+H2SO4
2[Cu(OH)2·CuCl2],[Cu(OH)2·CuCl2]+H2SO4![]() CuSO4+CuCl2+2H2O。现设计如下实验来制备硫酸铜晶体,装置如图:
CuSO4+CuCl2+2H2O。现设计如下实验来制备硫酸铜晶体,装置如图:
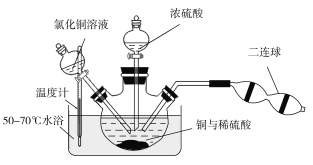
向铜和稀硫酸的混合物中加入氯化铜溶液,利用二连球鼓入空气,将铜溶解,当三颈烧瓶中呈乳状浑浊液时,滴加浓硫酸。
①盛装浓硫酸的仪器名称为___________。
②装置中加入CuCl2的作用是______________;最后可以利用重结晶的方法纯化硫酸铜晶体的原因为______________________。
③若开始时加入a g铜粉,含b g氯化铜溶质的氯化铜溶液,最后制得c g CuSO4·5H2O,假设整个过程中杂质不参与反应且不结晶,每步反应都进行得比较完全,则原铜粉的纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将浓度均为0.01 mol/L 的H2O2、H2SO4、KI、Na2S2O3溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。
(资料)
该“碘钟实验”的总反应:H2O2 +2S2O32-+2H+=S4O62-+2H2O
反应分两步进行:
反应A:H2O2+2I-+2H+=I2+2H2O
反应B:……
(1)反应B的离子方程式是______。对于总反应,I-的作用相当于______。
(2)为证明反应A、B的存在,进行实验Ⅰ。
a.向酸化的H2O2溶液中加入试剂X的水溶液,溶液变为蓝色。
b.再向得到的蓝色溶液中加入Na2S2O3溶液,溶液的蓝色褪去。
试剂X是______。
(3)为探究溶液变蓝快慢的影响因素,进行实验Ⅱ、实验Ⅲ。(溶液浓度均为0.01 mol/L)
试剂 序号 用量(mL) | H2O2 溶液 | H2SO4 溶液 | Na2S2O3 溶液 | KI溶液 (含淀粉) | H2O |
实验Ⅱ | 5 | 4 | 8 | 3 | 0 |
实验Ⅲ | 5 | 2 | x | y | z |
溶液从混合时的无色变为蓝色的时间:实验Ⅱ是30 min、实验Ⅲ是40 min。
①实验Ⅲ中,x、y、z所对应的数值分别是______。
②对比实验Ⅱ、实验Ⅲ,可得出的实验结论是______。
(4)为探究其他因素对该“碘钟实验”的影响,进行实验Ⅳ。
(溶液浓度均为0.01 mol/L)
试剂 序号 用量(mL) | H2O2 溶液 | H2SO4 溶液 | Na2S2O3 溶液 | KI溶液(含淀粉) | H2O |
实验Ⅳ | 4 | 4 | 9 | 3 | 0 |
实验过程中,溶液始终无明显颜色变化。
试结合该“碘钟实验”总反应方程式及反应A与反应B速率的相对快慢关系,解释实验Ⅳ未产生颜色变化的原因:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型: C、D为同周期元素,C核外电子总数是最外层层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是___________(填元素符号),其中C原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是____________(填分子式);A和B的氢化物所属的晶体类型分别为___________和___________。
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为____________,中心原子的杂化轨道类型为________________。
(4)单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为______________。
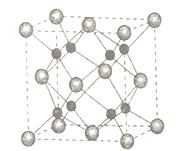
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为________;晶胞中A原子的配位数为____________;列式计算晶体F的密度(g cm-3 )__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-QkJ·mol-1(Q>0),某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
2SO3(g) ΔH=-QkJ·mol-1(Q>0),某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
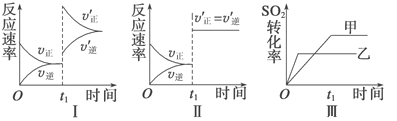
A. 图Ⅰ研究的是t0时刻增大O2的浓度对反应速率的影响
B. 图Ⅱ研究的是t0时刻加入催化剂后对反应速率的影响
C. 图Ⅲ研究的是催化剂对平衡的影响,且甲的催化效率比乙高
D. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1.5L的密闭容器中通入2molX2和3molY2的混合气体,在一定条件下发生反应:X2(g)+3Y2(g) ![]() 2Z(g) +4W(?) ΔH<0达到平衡时,容器内压强为反应开始时的0.8(相同温度下测量)。
2Z(g) +4W(?) ΔH<0达到平衡时,容器内压强为反应开始时的0.8(相同温度下测量)。
(1)该反应的化学平衡常数值为_______
(2)为提高X2的平衡转化率,下列措施可行的是___________
a.向体系中再通入一定量的X2
b.降温
c.移出部分Z
d.再冲入一定量Ar e.增大容器体积
(3)反应达平衡后,t1时刻改变条件,速率随时间变化如图所示,则t1对应条件改变为_______

a. 升温
b. 向体系中再通入一定量的W
c. 移走部分X2、Y2
d.减小容器的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某小组同学在烧杯中加入5mL1.0mol/L盐酸,再放入用砂纸打磨过的铝条,观察产生H2的速率,如图A所示,则该反应是_____________(填“吸热”或“放热”)反应,其能量变化可用图中的____________(填“B”或“C”)表示。

(2)已知拆开1mo1H-H键、1molN≡N键、lmolN-H键分别需要吸收的能量为436kJ、946kJ、391kJ。则生成1mo1 NH3时反应___________(填“放出”或“吸收”)________kJ 的热量。
(3)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是______(填序号),写出正极的电极反应_____________________。若构建原电池时两个电极的质量相等,当导线中通过0.05mol电子时,两个电极的质量差为________g。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com