
【题目】SO2、NO是大气污染物。吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
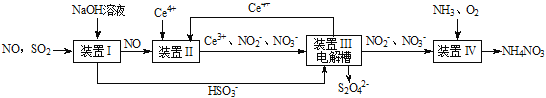
(1)装置Ⅰ中生成HSO3-的离子方程式为_____ 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。
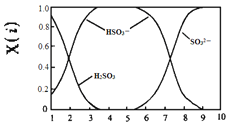
①下列说法正确的是_____(填字母序号)。
A.pH=8时,溶液中c(HSO3-) <c(SO32-)
B.pH=7时,溶液中c(Na+)=c(HSO3-)+c(SO32-)
C.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因:_____。
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出生成NO3-的离子方程式____。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如图所示。

①生成Ce4+的电极反应式为_________。
②生成Ce4+从电解槽的_____(填字母序号)口流出。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g/L,要使1m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2___L。(用含a代数式表示,计算结果保留整数)
【答案】SO2+OH-=HSO3- A、C HSO3-在溶液中存在电离平衡:HSO3-![]() H++SO32-,加入CaCl2溶液后,Ca2++SO32-=CaSO3,使电离平衡右移,c(H+)增大 NO+2H2O+3Ce4+=3Ce3++NO3-+4H+ Ce3+-e-=Ce4+ a 243a(242a、244a、
H++SO32-,加入CaCl2溶液后,Ca2++SO32-=CaSO3,使电离平衡右移,c(H+)增大 NO+2H2O+3Ce4+=3Ce3++NO3-+4H+ Ce3+-e-=Ce4+ a 243a(242a、244a、![]() )
)
【解析】
(1)二氧化硫是酸性氧化物,能和强碱氢氧化钠之间发生反应:SO2+OH-=HSO3-,NO和氢氧化钠之间不会反应;
(2)①A. pH=8时,根据图示得到的是亚硫酸钠和亚硫酸氢钠的混合物,根据离子的水解程度不同分析离子浓度大小;
B. 根据溶液中的电荷守恒分析;
C. 依据图像分析;
②依据钙离子对亚硫酸氢根离子电离平衡的影响效果作答;
(3)在酸性环境中,一氧化氮和Ce4+之间会发生氧化还原反应;
(4)Ce3+失电子被氧化生成Ce4+,在电解槽中阳极上失电子;电解过程中溶液中的阳离子从a口流出;
(5)依据得失电子守恒作答。
(1)过量的二氧化硫与氢氧化钠溶液反应生成亚硫酸氢根离子,离子方程式为SO2 + OH-=HSO3-;
(2)①B. pH=8时,根据图示得到的溶液是亚硫酸钠和亚硫酸氢钠的混合物,离子浓度大小顺序为:c(Na+)> c(SO32-)>c(HSO3-)> c(OH-)> c(H+),所以c(HSO3-) <c(SO32-),A项正确;
B. pH=7时,溶液为中性,氢离子浓度与氢氧根离子浓度相等,则c(Na+)+ c(H+)=2c(SO32-)+c(HSO3-)+ c(OH-),则推出c(Na+)=c(HSO3-) +2c(SO32-),B项错误;
C. 溶液的pH控制在4~5时,c(HSO3-)浓度最大,则为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右,C项正确。
所以答案选A、C。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,是因为亚硫酸氢钠溶液中存在电离平衡:HSO3-![]() SO32-+H+,加入CaCl2溶液后,Ca2++SO32-=CaSO3↓,使亚硫酸根离子的浓度减小,电离平衡右移,c(H+)增大,pH减小;
SO32-+H+,加入CaCl2溶液后,Ca2++SO32-=CaSO3↓,使亚硫酸根离子的浓度减小,电离平衡右移,c(H+)增大,pH减小;
(3)在酸性环境中,Ce4+将NO氧化为硝酸根离子,依据氧化还原反应规律可知其反应的离子方程式为:NO + 2H2O + 3Ce4+=3Ce3+ + NO3- + 4H+;
(4)①生成Ce4+为氧化反应,发生在阳极上,因此再生时生成的Ce4+在电解槽的阳极,其电极反应式为Ce3+-e-=Ce4+;
②生成Ce4+从电解槽的a口流出;
(5)溶液中的NO2-完全转化为NH4NO3,根据流程图可知装置Ⅳ中加入了氨气和氧气,因此NO2-被氧气氧化生成NO3-,氮元素化合价由+3价升高到+5价,氧气中氧元素由0价降低到-2价,根据得失电子守恒可知两者反应的关系式为:2NO2-~O2,n(NO2-)=![]() ,则需氧气的物质的量为:n(O2)=
,则需氧气的物质的量为:n(O2)=![]() n(NO2-)=
n(NO2-)=![]() ,其标准状况下的体积为:
,其标准状况下的体积为:![]() ×22.4L/mol=
×22.4L/mol=![]()
![]() 243a(或242a、244a、
243a(或242a、244a、![]() )。
)。


科目:高中化学 来源: 题型:
【题目】为验证氯元素比硫元素非金属性强,某化学实验小组设计如下实验,请回答下列问题:

(1)A中药品足量,发生的化学反应方程式____,当生成2.24 L Cl2(标况)时,被氧化的浓盐酸的物质的量为____;
(2)B中试剂为_______,该装置的作用是_______;
(3)C中盛有硫化钾溶液,该装置的现象是______;
(4)在D的KI溶液中添加少量_____,通过观察到________的现象,可以证明氯元素的非金属性大于碘元素。指出整个实验设计的不足之处_____;
(5)请阅读下列信息:
①硫化氢的水溶液酸性比氯化氢的弱 ②S2Cl2分子中氯元素显-1价 ③铜和氯气在加热条件下反应生成氯化铜,铜和硫在加热条件下反应生成硫化亚铜 ④沸点:硫磺>氯气 ⑤高氯酸的酸性大于硫酸
能证明氯元素的非金属性比硫元素强的是______(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,可逆反应A(气)+3B(气) ![]() 2C(气)达到平衡的标志是
2C(气)达到平衡的标志是
A.C生成的速率与C分解的速率相等
B.A、B、C的浓度相等
C.A、B、C的分子数比为1:3:2
D.单位时间生成n mol A,同时生成3n mol B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X(结构如图)是合成药物碘他拉酸的中间体,下列关于X的说法正确的是( )

A.分子式为C9H10N2O3
B.苯环上的二氯代物有2种
C.1mol X最多能与5 mol H2发生加成反应
D.既能与盐酸反应,又能与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验:①将0.1mol·L-1MgCl2溶液和0.5mol·L-1NaOH溶液等体积混合得到浊液;②取少量①中浊液,滴加0.1mol·L-1FeCl3溶液,出现红褐色沉淀;③将①中浊液过滤,取少量白色沉淀,滴加0.1mol·L-1FeCl3溶液,白色沉淀变为红褐色;④另取少量白色沉淀,滴加饱和NH4Cl溶液,沉淀溶解。下列说法中,不正确的是( )
A. 将①中所得浊液过滤,所得滤液中含少量Mg2+
B. 浊液中存在溶解平衡:Mg(OH)2(s)Mg2+(aq)+2OH-(aq)
C. 实验②和③均能说明Fe(OH)3比Mg(OH)2难溶
D. NH4Cl溶液中的NH4+可能是④中沉淀溶解的原因
查看答案和解析>>
科目:高中化学 来源: 题型:
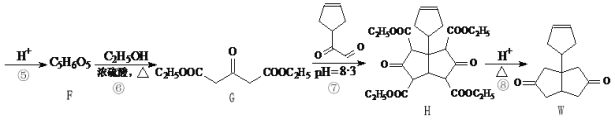
【题目】化合物W是一种医药化工合成中间体,其合成路线如下:
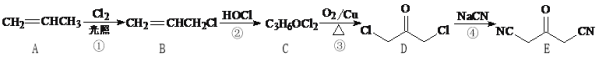
(1)B中官能团的名称是________和_________。
(2)反应④的反应类型是________。
(3)F的结构简式是_________。
(4)芳香化合物X是W的同分异构体,X能够发生银镜反应,核磁共振氢谱有五组峰,峰面积之比为6:4:3:2:1,写出X的一种结构简式:________。
(5)写出以1,2-二氯乙烷和![]() 为原料合成
为原料合成![]() 的合成路线流程图(无机试剂可任选)_________________。合成路线流程图示例如下:
的合成路线流程图(无机试剂可任选)_________________。合成路线流程图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2 是大气的主要污染物之一,某研究小组设计如图所示的装置对NO2 进行回收利用,装置中a、b均为多孔石墨电极。下列说法正确的是

A. a 为电池的负极,发生还原反应
B. 电子流向:a 电极→用电器→b 电极→溶液→a 电极
C. 一段时间后,b 极附近HNO3浓度增大
D. 电池总反应为4NO2 +O2 +2H2O= 4HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某实验小组为了探究影响化学反应速率的因素,进行了稀硫酸与金属铁反应的对照实验,实验数据如下:
实验序号 | 金属质量/g | 金属状态 | c(H2SO4)/molL-1 | V(H2SO4)/mL | 反应前溶液温度/℃ | 金属消失的时间/s |
1 | 0.10 | 丝 | 0.5 | 50 | 20 | 500 |
2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 50 |
3 | 0.10 | 丝 | 1.0 | 50 | 20 | 125 |
4 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 |
对比实验1和3,表明影响化学反应速率的因素是___;此外,该实验表明影响化学反应速率的因素还有___。
(2)用如图原电池装置可加快铁与稀硫酸反应的速率,其中铜作___(填“负极”或“正极”),铁的电极反应式是___。

(3)举出生活中你熟悉的一种二次电池___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述的化学反应状态,不一定是平衡状态的是( )
A.H2(g)+Br2(g)![]() 2HBr(g),恒温、恒容下,反应体系中气体的颜色保持不变
2HBr(g),恒温、恒容下,反应体系中气体的颜色保持不变
B.2NO2(g) ![]() N2O4(g),恒温、恒容下,反应体系中气体的压强保持不变
N2O4(g),恒温、恒容下,反应体系中气体的压强保持不变
C.CaCO3(s) ![]() CO2(g)+CaO(s),恒温、恒容下,反应体系中气体的质量保持不变
CO2(g)+CaO(s),恒温、恒容下,反应体系中气体的质量保持不变
D.3H2(g)+N2(g) ![]() 2NH3(g),反应体系中H2与N2的物质的量之比保持3∶1
2NH3(g),反应体系中H2与N2的物质的量之比保持3∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com