
【题目】(1)某实验小组为了探究影响化学反应速率的因素,进行了稀硫酸与金属铁反应的对照实验,实验数据如下:
实验序号 | 金属质量/g | 金属状态 | c(H2SO4)/molL-1 | V(H2SO4)/mL | 反应前溶液温度/℃ | 金属消失的时间/s |
1 | 0.10 | 丝 | 0.5 | 50 | 20 | 500 |
2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 50 |
3 | 0.10 | 丝 | 1.0 | 50 | 20 | 125 |
4 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 |
对比实验1和3,表明影响化学反应速率的因素是___;此外,该实验表明影响化学反应速率的因素还有___。
(2)用如图原电池装置可加快铁与稀硫酸反应的速率,其中铜作___(填“负极”或“正极”),铁的电极反应式是___。

(3)举出生活中你熟悉的一种二次电池___。
科目:高中化学 来源: 题型:
【题目】某柔性屏手机的柔性电池以碳纳米管作电极材料,以吸收ZnSO4溶液的有机高聚物作固态电解质,其电池总反应为MnO2+![]() Zn+(1+
Zn+(1+![]() )H2O+
)H2O+![]() ZnSO4
ZnSO4![]() MnOOH+
MnOOH+![]() ZnSO4[Zn(OH)2]3·xH2O.其电池结构如图1所示,图2是有机高聚物的结构片段。下列说法中不正确的是
ZnSO4[Zn(OH)2]3·xH2O.其电池结构如图1所示,图2是有机高聚物的结构片段。下列说法中不正确的是
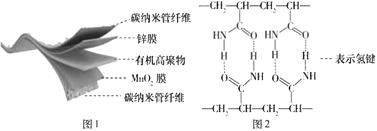
A.碳纳米管具有导电性,可用作电极材料
B.放电时,电池的正极反应为MnO2-e-+H+=MnOOH
C.充电时,Zn2+移向Zn膜
D.合成有机高聚物的单体是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2、NO是大气污染物。吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
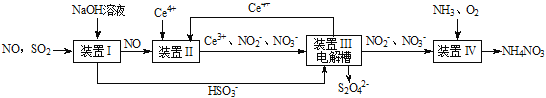
(1)装置Ⅰ中生成HSO3-的离子方程式为_____ 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。
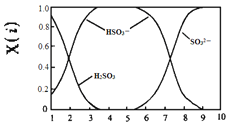
①下列说法正确的是_____(填字母序号)。
A.pH=8时,溶液中c(HSO3-) <c(SO32-)
B.pH=7时,溶液中c(Na+)=c(HSO3-)+c(SO32-)
C.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因:_____。
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出生成NO3-的离子方程式____。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如图所示。

①生成Ce4+的电极反应式为_________。
②生成Ce4+从电解槽的_____(填字母序号)口流出。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g/L,要使1m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2___L。(用含a代数式表示,计算结果保留整数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。
(1)工业制硫酸铜的方法很多。
①方法一、用浓硫酸和铜制取硫酸铜。该反应的化学方程式是_______。
②方法二、用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示:
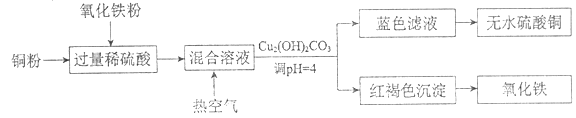
稀硫酸和氧化铁反应的离子方程式是_________;铜和上述反应得到的物质反应的离子方程式是_________;向混合溶液中通入热空气的反应的离子方程式是_________;分离蓝色滤液和红褐色沉淀的实验操作是_________。
(2)氨法脱硫技术可吸收硫酸工业尾气中的二氧化硫,同时制得硫酸铵。主要的工艺流程如下图所示:
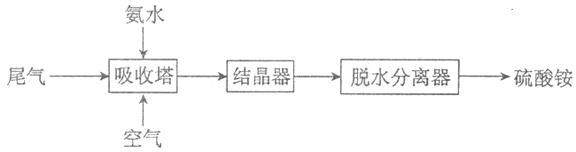
①吸收塔中发生反应的化学方程式是_________。
②检验硫酸铵中的NH4+的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。
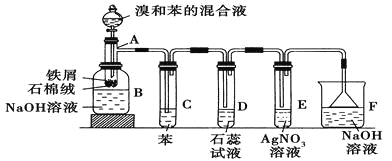
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式):________________________。
(2)试管C中苯的作用是 。反应开始后,观察D和E两试管,看到的现象分别为 、 。
(3)反应2~3 min后,在B中的NaOH溶液里可观察到的现象是 。
(4)在上述整套装置中具有防倒吸作用的仪器有 (填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2和H2在催化剂表面合成氨的微观历程及能量变化的示意图如下,用![]() 、
、![]() 、
、![]() 分别表示N2、H2、NH3,下列说法正确的是( )
分别表示N2、H2、NH3,下列说法正确的是( )
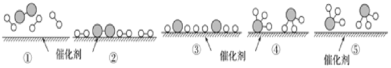
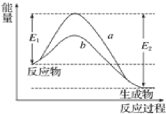
A.使用催化剂,改变了反应的途径,使合成氨反应放出的热量减少
B.该过程中,N2、H2吸收能量后断键形成N原子和H原子
C.该过程中,N原子和H原子形成含有非极性键的NH3分子
D.合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的()
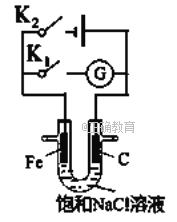
A. K1闭合,铁棒上发生的反应为2H++2e-=H2↑
B. K1闭合,石墨棒周围溶液碱性增强
C. K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D. K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(13分)硫酸铜晶体(CuSO4·5H2O)是铜盐中重要的无机化工原料,广泛应用于农业、电镀、饲料添加剂、催化剂、石油、选矿、油漆等行业。
Ⅰ.采用孔雀石[主要成分CuCO3·Cu(OH)2]、硫酸(70%)、氨水为原料制取硫酸铜晶体。其工艺流程如下:
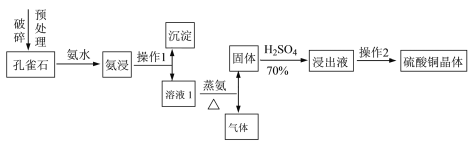
(1)预处理时要用破碎机将孔雀石破碎成粒子直径<1 mm,破碎的目的是____________________。
(2)已知氨浸时发生的反应为CuCO3·Cu(OH)2+8NH3·H2O![]() [Cu(NH3)4]2(OH)2CO3+8H2O,蒸氨时得到的固体呈黑色,请写出蒸氨时的反应方程式:______________________。
[Cu(NH3)4]2(OH)2CO3+8H2O,蒸氨时得到的固体呈黑色,请写出蒸氨时的反应方程式:______________________。
(3)蒸氨出来的气体有污染,需要净化处理,下图装置中合适的为___________(填标号);经吸收净化所得的溶液用途是_______________(任写一条)。

(4)操作2为一系列的操作,通过加热浓缩、冷却结晶、___________、洗涤、___________等操作得到硫酸铜晶体。
Ⅱ.采用金属铜单质制备硫酸铜晶体
(5)教材中用金属铜单质与浓硫酸反应制备硫酸铜,虽然生产工艺简洁,但在实际生产过程中不采用,其原因是______________________(任写两条)。
(6)某兴趣小组查阅资料得知:Cu+CuCl2![]() 2CuCl,4CuCl+O2+2H2O
2CuCl,4CuCl+O2+2H2O![]() 2[Cu(OH)2·CuCl2],[Cu(OH)2·CuCl2]+H2SO4
2[Cu(OH)2·CuCl2],[Cu(OH)2·CuCl2]+H2SO4![]() CuSO4+CuCl2+2H2O。现设计如下实验来制备硫酸铜晶体,装置如图:
CuSO4+CuCl2+2H2O。现设计如下实验来制备硫酸铜晶体,装置如图:
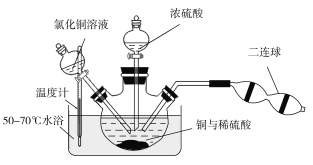
向铜和稀硫酸的混合物中加入氯化铜溶液,利用二连球鼓入空气,将铜溶解,当三颈烧瓶中呈乳状浑浊液时,滴加浓硫酸。
①盛装浓硫酸的仪器名称为___________。
②装置中加入CuCl2的作用是______________;最后可以利用重结晶的方法纯化硫酸铜晶体的原因为______________________。
③若开始时加入a g铜粉,含b g氯化铜溶质的氯化铜溶液,最后制得c g CuSO4·5H2O,假设整个过程中杂质不参与反应且不结晶,每步反应都进行得比较完全,则原铜粉的纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1.5L的密闭容器中通入2molX2和3molY2的混合气体,在一定条件下发生反应:X2(g)+3Y2(g) ![]() 2Z(g) +4W(?) ΔH<0达到平衡时,容器内压强为反应开始时的0.8(相同温度下测量)。
2Z(g) +4W(?) ΔH<0达到平衡时,容器内压强为反应开始时的0.8(相同温度下测量)。
(1)该反应的化学平衡常数值为_______
(2)为提高X2的平衡转化率,下列措施可行的是___________
a.向体系中再通入一定量的X2
b.降温
c.移出部分Z
d.再冲入一定量Ar e.增大容器体积
(3)反应达平衡后,t1时刻改变条件,速率随时间变化如图所示,则t1对应条件改变为_______

a. 升温
b. 向体系中再通入一定量的W
c. 移走部分X2、Y2
d.减小容器的体积
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com