
【题目】苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。
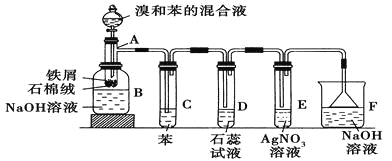
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式):________________________。
(2)试管C中苯的作用是 。反应开始后,观察D和E两试管,看到的现象分别为 、 。
(3)反应2~3 min后,在B中的NaOH溶液里可观察到的现象是 。
(4)在上述整套装置中具有防倒吸作用的仪器有 (填字母)。
【答案】(1)![]()
(2)吸收HBr气体中的Br2蒸气,D中石蕊试液变红,E中产生浅黄色沉淀
(3)NaOH溶液的底部有无色油珠产生(或分层,底部有无色油状液体)
(4)DEF(漏选得2分,错选不得分)
【解析】液溴和苯的混合物滴加到有铁粉的石棉绒上,液溴和苯在Fe作催化剂条件下能发生取代反应生成溴苯与HBr,溴和苯都是易挥发的物质,所以反应生成的溴苯及大部分未的反应苯和溴流入到下面的氢氧化钠溶液中,生成的溴化氢及挥发出的溴、苯通过C装置,苯和溴被吸收,溴化氢气体到D装置中能使石蕊变红,在E装置中溴化氢使硝酸银产生浅黄色沉淀,尾气用氢氧化钠吸收,由于溴化氢极易溶于水,所以F装置要用防止倒吸装置。
(1)Fe与溴反应生成溴化铁,苯和液溴在溴化铁作催化剂条件下能发生取代反应生成溴苯与HBr,反应方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)溴易挥发,易溶于有机溶剂,所以用C来吸收吸收溴化氢中的溴和挥发的有机物蒸汽,防止对溴化氢的检验造成干扰;溴化氢溶于水电离产生氢离子和溴离子,所以溶液显酸性,能使石蕊变红色,硝酸银中的银离子与溴离子反应生成淡黄色的沉淀;故答案为:吸收HBr气体中的Br2蒸气;D中紫色石蕊溶液变红,E中产生淡黄色沉淀;
(3)苯与液溴发生取代反应生成溴苯和溴化氢,溴苯是密度大于水,无色的油状液体,溴化氢易挥发,能与水蒸气结合成氢溴酸液滴,溴化铁与氢氧化钠反应生成红褐色的氢氧化铁沉淀,故答案为:NaOH溶液的底部有无色油珠产生,液面上产生白雾;
(4)装置D和E导管口在液面上方,能防止倒吸,倒置漏斗增大了气体与氢氧化钠溶液的接触面积,有缓冲作用,能够防止倒吸,故答案为:DEF。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列是某学生自己总结的一些规律,其中正确的是
A.有的无机化学反应不属于化合、分解、置换、复分解中的任何一种反应
B.某物质在固态时能导电,可确认该物质是金属单质
C.一种元素在同一物质中可显示不同价态,但一定是该元素的相邻价态
D.氧化物只可能是氧化产物,不可能是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验室使用的浓盐酸的溶质的质量分数通常为36.5%,密度为1.25g/mL。
(1)该盐酸的物质的量浓度为__________mol/L。
(2)现有一种0.2mol/L的稀盐酸的含义是_________(选填字母)。
A.1L水中含有0.2mol HCl
B.1L溶液中含有0.1mol H+
C.将7.1gHCl溶于1L水所配成的溶液
D.从100mL该溶液中取出10mL,剩余溶液的物质的量浓度仍为0.2mol/L
(3)用上述实验室的浓盐酸来配制500mL1 mol/L的稀盐酸,请在下列操作步骤中填写有关的空格:
①用量筒量取________mL的浓盐酸;(精确到小数点后一位)
②向盛有少量蒸馏水的烧杯中,沿_________慢慢注入浓盐酸;
③将已冷却至室温的盐酸溶液沿玻璃棒注入________mL的容量瓶中;
④用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
⑤继续向容量瓶中加蒸馏水,直至液面接近刻度线1~2cm处;
⑥改用___________________逐滴加蒸馏水,使溶液凹液面恰好与刻度线相切;
⑦盖好容量瓶塞,反复颠倒,摇匀;
⑧将配好的稀硫酸倒入试剂瓶中,贴好标签。
(4)由于操作不当,会引起实验误差。下列情况对所配制的盐酸溶液的物质的量浓度有何影响?(用“偏高”、“偏低”、“无影响”填空)
①容量瓶用蒸馏水洗涤后残留有少量的水_____________;
②定容时,某同学观察液面的情况如图所示_____________;
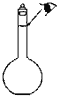
③摇匀后,发现溶液的液面低于刻度线,又加水至刻度线____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用16mol/L 浓硫酸配制100mL 2.0mol/L 稀硫酸的实验步骤如下:①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解 ④转移、洗涤 ⑤定容 ⑥摇匀。回答下列问题:
(1)该实验所需的玻璃仪器:______、玻璃棒、烧杯、胶头滴管、量筒。
(2)所需浓硫酸的体积是_____,量取浓硫酸所用的量筒的规格是____(规格从下列中选用A.10mL B.20mL C.50mL D.100mL)。
(3)第⑤步定容的具体实验操作是_______。
(4)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
A.容量瓶用蒸馏水洗涤后残留有少量的水____。
B.转移溶液前未冷却至室温_____。
C.定容时仰视溶液的凹液面______。
D. 向容量瓶中转移溶液时,不慎有少量溶液洒在容量瓶外面____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4LCl2通入足量的NaOH溶液充分反应,有NA个电子转移
B. 100 mL 1 mol·L1FeCl3溶液中所含Fe3+的数目为0.1NA
C. lmolSO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子
D. 84gNaHCO3固体含有CO32-离子的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图在衬白纸的玻璃片中央放置适量的KMnO4颗粒,在周围分别滴加一滴含有酚酞的澄清石灰水、FeCl2溶液,然后在KMnO4晶体上滴加适量的浓盐酸,迅速盖好表面皿。提示:实验室中所用的少量氯气可以用下述原理制取:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,此反应在常温下即能进行。
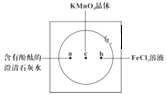
(1)浓盐酸在反应中表现出来的性质是______ (填写编号),氧化剂与还原剂物质的量之比为______ ,氧化产物为______ 。
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(2)产生0.1 mol Cl2,则转移电子的物质的量为 ______ mol。
(3)a处反应的化学方程式是___________________________,工业上用此原理制取漂白粉。
(4)b处离子方程式是________________________。
(5)高锰酸钾标准溶液经常用来滴定测量物质的含量。用高锰酸钾法间接测定石灰石中CaCO3的含量的方法为:称取试样0.1250g,用稀盐酸溶解后加入(NH4)2C2O4得CaC2O4沉淀。沉淀经过滤洗涤后溶于稀硫酸中。滴定生成的H2C2O4用去浓度为0.016mo/LKMnO4溶液25.00mL。
①写出CaC2O4沉淀溶解的离子方程式:___________________
②配平并完成下列高锰酸钾滴定草酸反应的离子方程式: ____MnO4-+___H2C2O4+____=___Mn2++___CO2↑+____
③石灰石中CaCO3的百分含量:_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于难溶电解质溶解平衡的说法正确的是
A. 可直接根据 Ksp 的数值大小比较难溶电解质在水中的溶解度大小
B. 在 AgCl 的饱和溶液中,加入蒸馏水, Ksp(AgCl)不变
C. 难溶电解质的溶解平衡过程是可逆的,且在平衡状态时 v溶解=v沉淀=0
D. 25℃时, Ksp(AgCl)>Ksp(AgI),向 AgCl 的饱和溶液中加入少量 KI 固体,一定有黄色沉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于0.1 mol·L-1 Na2SO4溶液的叙述中,正确的是
A.从1 L该溶液中取出100 mL,则取出溶液中Na2SO4的物质的量浓度为 0.01 mol·L-1
B.0.5 L该溶液中钠离子的物质的量0.1 mol·L-1
C.1 L该溶液中含有Na2SO4的质量为142 g
D.取该溶液10mL,加水稀释至100 mL后Na2SO4的物质的量浓度为0.01 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com