
 ;在该物质含有的化学键是离子键、非极性共价键,
;在该物质含有的化学键是离子键、非极性共价键,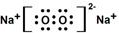 ;离子键、非极性共价键;
;离子键、非极性共价键;

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
 教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol?L-1H2C2O4溶液 | 30mL 0.01mol?L-1KMnO4溶液 |
| ② | 20mL 0.2mol?L-1H2C2O4溶液 | 30mL 0.01mol?L-1KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化钠可用食物调整碱性的添加剂 |
| B、棉、麻完全燃烧可以生成CO2和H2O |
| C、脂肪在一定条件下都能发生水解反应 |
| D、汽油、柴油、煤油的主要成分都是碳氢化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、人住前,房间内保持一定温度并通风 |
| B、紧密门窗一段时间后入住 |
| C、请环境监测部门检测室内甲醛含量,低于国家标准后才可入住 |
| D、装修尽可能选择在温度较高的季节 |
查看答案和解析>>
科目:高中化学 来源: 题型:
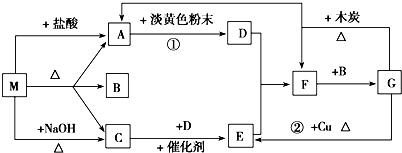
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、C气体的体积分数增大 |
| B、m+n>p |
| C、气体A的转化率升高 |
| D、平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸溶液中滴入石蕊呈红色,证明醋酸是弱电解质 |
| B、液态HCl不导电,证明HCl是共价化合物 |
| C、饱和石灰水中加入少量CaO,恢复至室温,溶液的pH增大 |
| D、向Na2CO3溶液中加入少量NaOH固体,抑制CO32-水解,溶液pH减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com