
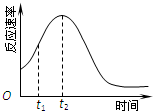
 教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol?L-1H2C2O4溶液 | 30mL 0.01mol?L-1KMnO4溶液 |
| ② | 20mL 0.2mol?L-1H2C2O4溶液 | 30mL 0.01mol?L-1KMnO4溶液 |


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
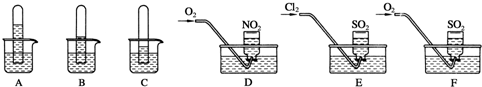
查看答案和解析>>
科目:高中化学 来源: 题型:
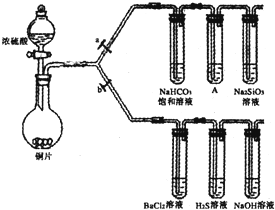
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤、预期现象 | 结论 |
| ①溶液中加入适量四氯化碳 | 假设1正确 |
| ②向溶液中加入 | 假设2正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定没有乙烯 |
| B、一定有乙烯 |
| C、一定没有甲烷 |
| D、一定有甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
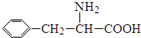 )是合成APM的原料之一.苯丙氨酸的一种合成途径如图所示:
)是合成APM的原料之一.苯丙氨酸的一种合成途径如图所示: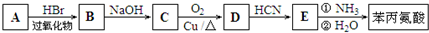
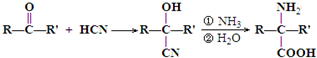
查看答案和解析>>
科目:高中化学 来源: 题型:
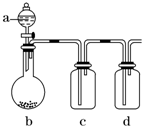
| A、若a为浓硫酸,b为Na2SO3固体,c中盛石蕊溶液,则c中溶液先变红后褪色 |
| B、若a为浓盐酸,b为MnO2,c中盛品红溶液,则c中溶液不褪色 |
| C、若a为醋酸溶液,b为贝壳,c中盛过量澄清石灰水,则c中溶液变浑浊 |
| D、若a为浓氨水,b为生石灰,c中盛AlCl3溶液,则c中产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com