
【题目】下列物质长期放置在空气中,变质过程中没发生氧化还原反应的是
A. 漂白粉 B. Na2O C. Na D. Na2O2
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
【题目】下列实验可实现鉴别目的是( )
A.用NaOH溶液鉴别(NH4)2SO4和NH4Cl
B.用AgNO3溶液鉴别NaBr溶液和KI溶液
C.用焰色反应鉴别NaCl和NaNO3
D.用澄清石灰水鉴别CO2和SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一团棉花包裹少量过氧化钠放在石棉网上,将CO2气体缓缓通入棉花中的过氧化钠上,棉花很快燃烧起来,实验分析可知,下列表达不正确的是( )
A. 反应生成的O2有利于棉花燃烧 B. 过氧化钠与CO2反应放热
C. CO2对棉花燃烧起助燃作用 D. 过氧化钠与CO2反应属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由金红石(TiO2)制取单质Ti涉及的步骤为:TiO2→TiCl4![]()
已知:①C(s)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H2=-566 kJ·mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) △H3=+141 kJ·mol-1
则TiO2(s) +2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H是
A. -80 kJ·mol-1 B. -160 kJ·mol-1 C. +160 kJ·mol-1 D. +80kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于四个图象的说法正确的是( ) 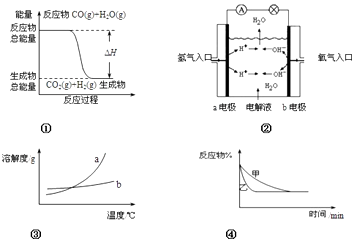
A.图①表示化学反应中能量的变化,反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H>0
B.图②为氢氧燃料电池示意图,正、负极通入的气体体积之比为2:1
C.图③表示物质a、b的溶解度曲线,可以用结晶方法从a、b混合物中提纯a
D.图④可以表示压强对可逆反应2A(g)+2B(g) ![]() 3C(g)+D(s)的影响,且乙的压强大
3C(g)+D(s)的影响,且乙的压强大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下的密闭容器中:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-905.9 kJ·mol-1,下列叙述正确的是
4NO(g)+6H2O(g) ΔH=-905.9 kJ·mol-1,下列叙述正确的是
A. 平衡后升高温度,混合气体中NO含量增大
B. 平衡后降低压强,混合气体平均摩尔质量增大
C. 4molNH3和5molO2反应,达到平衡时放出热量为905.9kJ
D. 平衡时,将水蒸气移除部分,此时逆反应速率降低,正反应速率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:2CH3OH(g)═CH3OCH3(g)+H2O(g)
下列说法正确的是( )
容器 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
A.该反应的正方应为吸热反应
B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH30.15mol和H2O 0.10mol,则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题: 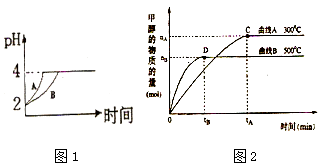
(1)常温下,取 pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图1所示.则图中表示醋酸溶液中pH变化的曲线是 填“A”或“B”). 设盐酸中加入的Zn质量为m1 , 醋酸溶液中加入的Zn质量为 m2 . 则 m1 m2 ( 选填“<”、“=”、“>”).
(2)如图2所示,在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO(g)+2H2(g)CH3OH(g).升高温度,K值(填“增大”、“减小”或“不变”).在500℃,从反应开始到达到平衡,用氢气浓度变化表示的平均反应速率v(H2)= .
(3)某温度下Ksp=2×10 ﹣11 , 若该温度下某MgSO4溶液里c(Mg 2+)=0.002molL﹣1 , 如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于;该温度下,在0.20L的0.002mol/LMgSO4溶液中加入等体积的0.10mol/L的氨水溶液,该温度下电离常数Kb(NH3H2O)=2×10﹣5 , 试计算(填“有”或“无”) Mg(OH)2沉淀生成?
(4)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色.在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO32﹣水解所致.请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】As2O3在医药、电子等领域有重要应用.某含砷元素(As)的工业废水经如图1流程转化为粗As2O3 . 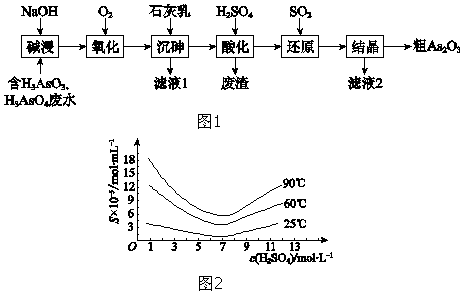
(1)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐.H3AsO4转化为Na3AsO4反应的化学方程式是 .
(2)“氧化”时,1mol AsO33﹣转化为AsO43﹣至少需要O2mol.
(3)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有: a.Ca(OH)2(s)Ca2+(aq)+2OH﹣(aq)△H<0
b.5Ca2++OH﹣+3AsO43﹣Ca5(AsO4)3OH△H>0
研究表明:“沉砷”的最佳温度是85℃.
用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是 .
(4)“还原”过程中H3AsO4转化为H3AsO3 , 反应的化学方程式是 .
(5)“还原”后加热溶液,H3AsO3分解为As2O3 , 同时结晶得到粗As2O3 . As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图2所示.为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是 .
(6)下列说法中,正确的是(填字母). a.粗As2O3中含有CaSO4
b.工业生产中,滤液2可循环使用,提高砷的回收率
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com