
【题目】下列关于四个图象的说法正确的是( ) 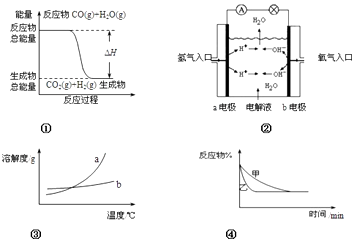
A.图①表示化学反应中能量的变化,反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H>0
B.图②为氢氧燃料电池示意图,正、负极通入的气体体积之比为2:1
C.图③表示物质a、b的溶解度曲线,可以用结晶方法从a、b混合物中提纯a
D.图④可以表示压强对可逆反应2A(g)+2B(g) ![]() 3C(g)+D(s)的影响,且乙的压强大
3C(g)+D(s)的影响,且乙的压强大
【答案】C
【解析】解、A、因反应物的总能量>生成物的总能量,根据能量守恒原理,该反应为放热,△H<0,故A错误;
B、因氢氧燃料电池的总反应:2H2+O2=2H2O,负极放电的物质为H2 , 正极放电的物质为O2 , 两者的物质的量之比为2,故B错误;
C、因物质a的溶解度随温度变化较大,而物质b的溶解度随温度变化不大,因此,可以用降温结晶方法从a、b混合物中析出物质a,故C正确;
D、因乙先到达平衡,故乙的压强大,甲的压强小,但增大压强,平衡向正反应方向移动,而图象中平衡未发生移动,乙应是加入催化剂的原因,故D错误;
故选:C.
【考点精析】关于本题考查的溶解度、饱和溶液的概念,需要了解在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液,叫作这种溶质的饱和溶液;还能继续溶解某种溶质的溶液,叫作不饱和溶液;在一定温度下,某固体物质在100克溶剂里达到饱和状态时所溶解的质量,叫作这种物质在这种物质在这种溶剂里的溶解度才能得出正确答案.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】铜及其化合物在生产、生活中应用广泛。回答下列问题:
(1)用新制Cu(OH)2与葡萄糖反应可制备Cu2O,该反应中葡萄糖是___________(填“氧化剂”或“还原剂”)。
(2)用H2O2、H2SO4混合溶液浸泡废铜屑可制备CuSO4,实现“变废为宝”。若将该反应设计成原电池,则正极的电极反应式为________________。
(3)氧化亚铜(CuCl)是微溶于水、易被氧化的白色固体,广泛用作有机合成催化剂、化学分析试剂等。用NH4NO3氧化海绵铜(含Cu和CuO)制备氯化亚铜的部分流程如下:

①步骤Ⅰ中,当0.2molNH4NO3参加反应时,反应中有1mol电子发生转移,则铜参加反应的离子方程式为________________________。
②步骤Ⅱ中充分反应后,分离出产品的方法是_________________。
③步骤Ⅱ中物质X可选用_________________(填字母)
a.SO2 b.Cl2 c.H2O2 d.(NH4)2SO3
该物质需过量的原因之一是加快反应速率,另一原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、W、Q在元素周期表中的相对位置如图所示。常温下,Al能溶于W的最高价氧化物对应水化物的稀溶液,却不溶于其浓溶液。下列说法正确的是
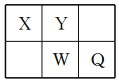
A. Y的最高化合价为+6
B. 简单氢化物的稳定性:Y>W
C. 简单离子半径:W>Q>Y>X
D. X、Y、W不可能同时存在于一种离子化合物中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有溴化钾溶液的试管中加入足量的氯水,再加少量的CCl4,充分震荡静置后( )
A.溶液分层,下层红棕色B.溶液分层,上层红棕色
C.溶液分层,下层紫红色D.溶液分层,上层紫红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含SO2的烟气会形成酸雨,工业上常利用Na2SO3溶液作为吸收液脱除烟气中的SO2 . 随着SO2的吸收,吸收液的pH不断变化.下列粒子浓度关系一定正确的是( )
A.Na2SO3溶液中存在: ![]()
B.已知NaHSO3溶液pH<7,该溶液中: ![]()
C.当吸收液呈中性时: ![]()
D.当吸收液呈酸性时: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应3Cl2 +6NaOH→5NaCl+NaClO3 +3H2O中,被氧化和被还原的氯原子的个数比为( )
A.1︰1B.1︰2C.1︰5D.1︰6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a mol FeS与b mol FeO投入到V L、c mol·L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3和H2SO4的混合液,则反应中未被还原的硝酸可能为
①(a+b)×63 g ②(a+b)×189 g ③ (Vc-![]() ) mol ④
) mol ④![]() mol
mol
A. ①④ B. ②③ C. ①③ D. ②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com