
【题目】a mol FeS与b mol FeO投入到V L、c mol·L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3和H2SO4的混合液,则反应中未被还原的硝酸可能为
①(a+b)×63 g ②(a+b)×189 g ③ (Vc-![]() ) mol ④
) mol ④![]() mol
mol
A. ①④ B. ②③ C. ①③ D. ②④
 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】下列关于四个图象的说法正确的是( ) 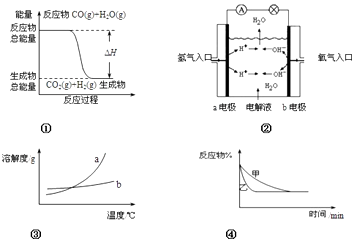
A.图①表示化学反应中能量的变化,反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H>0
B.图②为氢氧燃料电池示意图,正、负极通入的气体体积之比为2:1
C.图③表示物质a、b的溶解度曲线,可以用结晶方法从a、b混合物中提纯a
D.图④可以表示压强对可逆反应2A(g)+2B(g) ![]() 3C(g)+D(s)的影响,且乙的压强大
3C(g)+D(s)的影响,且乙的压强大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法不正确的是( ) 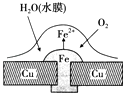
A.正极的电极反应为:2H++2e﹣═H2↑
B.此过程中还涉及反应:4Fe(OH)2+2H2O+O2═4Fe(OH)3
C.此过程中铜并不被腐蚀
D.此过程中电子从Fe移向Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,属于强电解质的是___ __,属于非电解质的是___ _____(均填序号)
①Cu②液氨③氯水④氯化钠晶体⑤硫酸溶液⑥干冰⑦BaSO4⑧液氧⑨金刚石⑩石墨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图装置的叙述,正确的是( ) 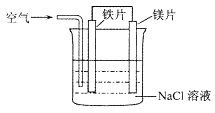
A.镁片为负极,镁片上产生黄绿色气体
B.铁片为阳极,铁片上产生无色气体
C.溶液中铁片与镁片之间产生白色沉淀
D.溶液的pH将逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】As2O3在医药、电子等领域有重要应用.某含砷元素(As)的工业废水经如图1流程转化为粗As2O3 . 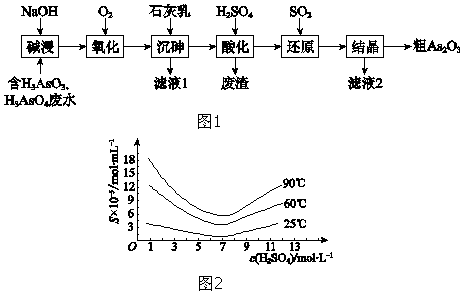
(1)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐.H3AsO4转化为Na3AsO4反应的化学方程式是 .
(2)“氧化”时,1mol AsO33﹣转化为AsO43﹣至少需要O2mol.
(3)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有: a.Ca(OH)2(s)Ca2+(aq)+2OH﹣(aq)△H<0
b.5Ca2++OH﹣+3AsO43﹣Ca5(AsO4)3OH△H>0
研究表明:“沉砷”的最佳温度是85℃.
用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是 .
(4)“还原”过程中H3AsO4转化为H3AsO3 , 反应的化学方程式是 .
(5)“还原”后加热溶液,H3AsO3分解为As2O3 , 同时结晶得到粗As2O3 . As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图2所示.为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是 .
(6)下列说法中,正确的是(填字母). a.粗As2O3中含有CaSO4
b.工业生产中,滤液2可循环使用,提高砷的回收率
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用符号A:质子数,B:中子数,C:核外电子数,D:最外层电子数,E:电子层数,填写下列各空。
(1)原子种类由_____决定。
(2)元素的种类由_____决定
(3)元素的化合价主要由____决定
(4)核电荷数由_____决定。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中,由H2和CO直接制备二甲醚(CH3OCH3),其过程包含以下反应:
i.CO(g)+2H2(g) ![]() CH3OH(g) H1=90.1kJ·mol1
CH3OH(g) H1=90.1kJ·mol1
ii.2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) H2=24.5kJ·mol1
CH3OCH3(g)+H2O(g) H2=24.5kJ·mol1
当其他条件相同时,由H2和CO直接制备二甲醚的反应中,CO平衡转化率随条件X 的变化曲线如右图所示。下列说法正确的是( )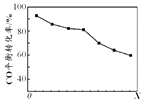
A.由H2和CO直接制备二甲醚的反应为放热反应
B.条件X为压强
C.X增大,二甲醚的产率一定增大
D.X增大,该反应的平衡常数一定减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com