
【题目】密闭容器中,由H2和CO直接制备二甲醚(CH3OCH3),其过程包含以下反应:
i.CO(g)+2H2(g) ![]() CH3OH(g) H1=90.1kJ·mol1
CH3OH(g) H1=90.1kJ·mol1
ii.2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) H2=24.5kJ·mol1
CH3OCH3(g)+H2O(g) H2=24.5kJ·mol1
当其他条件相同时,由H2和CO直接制备二甲醚的反应中,CO平衡转化率随条件X 的变化曲线如右图所示。下列说法正确的是( )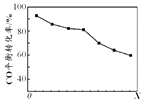
A.由H2和CO直接制备二甲醚的反应为放热反应
B.条件X为压强
C.X增大,二甲醚的产率一定增大
D.X增大,该反应的平衡常数一定减小
【答案】A
【解析】A . 将i×2+ ii得:2CO(g) + 4H2(g) ![]() CH3OCH3(g) + H2O(g) H= 204.7 kJ·mol1,因此由H2和CO直接制备二甲醚的反应为放热反应,故A符合题意;
CH3OCH3(g) + H2O(g) H= 204.7 kJ·mol1,因此由H2和CO直接制备二甲醚的反应为放热反应,故A符合题意;
B. 根据,2CO(g) + 4H2(g) ![]() CH3OCH3(g) + H2O(g),压强越大,CO平衡转化率越大,与图像不符,故B不符合题意;
CH3OCH3(g) + H2O(g),压强越大,CO平衡转化率越大,与图像不符,故B不符合题意;
C. X增大,CO平衡转化率减小,二甲醚的产率可能减小,故C不符合题意;
D. 根据图像,X可能是温度,温度升高,平衡逆向移动,反应的平衡常数减小,X也可能是减小压强,平衡逆向移动,CO平衡转化率减小,但平衡常数不变,故D不符合题意。
所以答案是:A
【考点精析】根据题目的已知条件,利用化学平衡状态本质及特征的相关知识可以得到问题的答案,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).


科目:高中化学 来源: 题型:
【题目】a mol FeS与b mol FeO投入到V L、c mol·L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3和H2SO4的混合液,则反应中未被还原的硝酸可能为
①(a+b)×63 g ②(a+b)×189 g ③ (Vc-![]() ) mol ④
) mol ④![]() mol
mol
A. ①④ B. ②③ C. ①③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向一恒容密闭容器中充入2 mol SO2和1 mol O2,在一定条件下发生反应: 2SO2+O2![]() 2SO3,下列有关说法正确的是( )
2SO3,下列有关说法正确的是( )
A. 当O2的浓度不变时,反应达到平衡状态
B. 达到化学平衡时,正反应和逆反应的速率相等且都为零
C. 当单位时间消耗a mol O2,同时消耗2a mol SO2时,反应达到平衡状态
D. 当SO2、O2、SO3的分子数比为2∶1∶2时,反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置的说法中正确的是( )
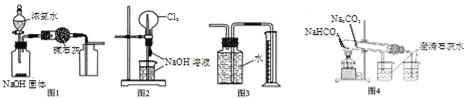
A. 图1装置可制取、收集干燥纯净的NH3
B. 图2装置可以完成“喷泉”实验
C. 图3装置可测量Cu 与浓硝酸反应产生气体的体积
D. 图4装置可用比较NaHCO3和Na2CO3的热稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业回收铅蓄电池中的铅,常用Na2CO3或NaHCO3溶液处理铅膏(主要成分PbSO4)获得PbCO3:PbSO4(s) + CO32-(aq) ![]() PbCO3(s) + SO42-(aq) K = 2.2×105。 经处理得到的PbCO3灼烧后获得PbO,PbO再经一步转变为Pb。下列说法正确的是( )
PbCO3(s) + SO42-(aq) K = 2.2×105。 经处理得到的PbCO3灼烧后获得PbO,PbO再经一步转变为Pb。下列说法正确的是( )
A.PbSO4的溶解度小于PbCO3
B.处理PbSO4后,Na2CO3或NaHCO3溶液的pH升高
C.若用等体积、等浓度的Na2CO3和NaHCO3溶液分别处理PbSO4 , Na2CO3溶液中的PbSO4转化率较大
D.整个过程涉及一个复分解反应和两个氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。 请回答该实验中的问题。
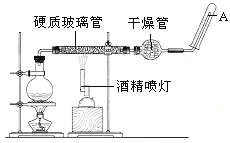
(1)写出该反应的化学方程式__________________________________________。
(2)玻璃管中石棉绒的作用是__________________________________,圆底烧瓶中盛装水,烧瓶里应事先放置_________________,其作用是______________。
(3)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分是_______________________,若溶液未变红色则说明硬质试管中固体物质的成分是_______________________。
(4)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是___________________(用离子方程式表示)。
(5)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关的反应的化学方程式_____________________________ ,________________________。
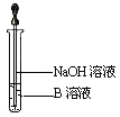
(6)一段时间后,该同学发现(4)中未变红的溶液变成红色,说明Fe2+ 具有____性。由此可知,实验室中含Fe2+的盐溶液需要现用现配制,并且配制含Fe2+的盐溶液时应加入少量____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,甲、乙两容器分别盛有甲烷(CH4)气体和氨气(NH3),已知它们所含原子个数相同,则甲、乙两容器的体积比为
A. 4 :5 B. 5 :4 C. 4 :3 D. 1 :1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组气体中,通常情况下能共存,并都能用浓硫酸和碱石灰干燥的是
A.SO2,H2S,O2B.NH3,H2,N2
C.N2,H2,COD.HCl,Cl2,CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com