
����Ŀ���ڳ����£�Fe��ˮ������Ӧ�����ڸ����£�Fe��ˮ�����ɷ�����Ӧ��Ӧ������װ�ã���Ӳ�ʲ������з��뻹ԭ���ۺ�ʯ���Ļ������ȣ���ͨ��ˮ�������Ϳ�����ɸ����¡�Fe��ˮ�����ķ�Ӧʵ�顱�� ��ش��ʵ���е����⡣
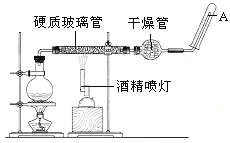
��1��д���÷�Ӧ�Ļ�ѧ����ʽ__________________________________________��
��2����������ʯ����������__________________________________��Բ����ƿ��ʢװˮ����ƿ��Ӧ���ȷ���_________________����������______________��
��3����ͬѧ��ȷ����Ӧ��Ӳ���Թ��й������ʵijɷ֣����������ʵ�鷽����
�ٴ�Ӳ���Թ���ȴ��ȡ�������еĹ�����������ϡ�������ҺB��
��ȡ������ҺB�μ�KSCN��Һ������Һ���ɫ��˵��Ӳ���Թ��й������ʵijɷ���_______________________������Һδ���ɫ��˵��Ӳ���Թ��й������ʵijɷ���_______________________��
��4����ͬѧ������ʵ�鷽��������ʵ�飬�����Һδ���ɫ��ԭ����___________________�������ӷ���ʽ��ʾ����
��5����ͬѧ������ȡ������ҺB��ʹ���NaOH��Һ��Ӧ������ͼ��ʾ�IJ������ɹ۲쵽���ɰ�ɫ������Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ��������д��������������صķ�Ӧ�Ļ�ѧ����ʽ_____________________________ ��________________________��
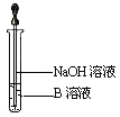
��6��һ��ʱ���ͬѧ������4����δ������Һ��ɺ�ɫ��˵��Fe2+ ����____�ԡ��ɴ˿�֪��ʵ�����к�Fe2+������Һ��Ҫ���������ƣ��������ƺ�Fe2+������ҺʱӦ��������____________��
���𰸡� 3Fe+4H2O(g)![]() Fe3O4+4H2 ���۵����壬����������ˮ�����ĽӴ���� ���Ƭ ��ֹ���� һ����Fe3O4,������Fe Fe3O4��Fe Fe+ 2Fe3+= 3Fe2+ FeSO4+2NaOH=Fe(OH)2+Na2SO4 4Fe(OH)2+O2+2H2O= 4Fe(OH)3 ��ԭ ����
Fe3O4+4H2 ���۵����壬����������ˮ�����ĽӴ���� ���Ƭ ��ֹ���� һ����Fe3O4,������Fe Fe3O4��Fe Fe+ 2Fe3+= 3Fe2+ FeSO4+2NaOH=Fe(OH)2+Na2SO4 4Fe(OH)2+O2+2H2O= 4Fe(OH)3 ��ԭ ����
�����������⿼��ʵ�鷽����������ۣ���1����ʵ����֤����ˮ������Ӧ���˷�Ӧ����ʽΪ��3Fe+4H2O(g) ![]() Fe3O4+4H2����2��ʯ���������������۵����壬����������ˮ�����ĽӴ������Ϊ��ֹҺ��ı��У������ƿ��Ӧ���ȼ����ʯ�����Ƭ����3������ҺB�еμ�KSCN��Һ����Һ��죬˵����ҺB�к���Fe3��������������һ������Fe3O4�����ܺ�������û�з�Ӧ��Fe�������Һ����죬˵����Һ�в���Fe3��������������һ������Fe3O4��Fe����4��Fe3O4�����ᷴӦ����Fe3����Fe2����Fe��Fe3��������Ӧ��Fe��2Fe3��=3Fe2������5������NaOH���ְ�ɫ��������ɫ����ΪFe(OH)2������FeSO4��2NaOH=Fe(OH)2����Na2SO4��Ѹ��ת��ɻ���ɫ������Ϊ���ɫ��������ΪFe(OH)2������������Fe(OH)3�������ķ�Ӧ����ʽΪ4Fe(OH)2��O2��2H2O=4Fe(OH)3����6����4����δ������Һ��죬˵��Fe2��������������Fe3��������Fe2���Ļ�ԭ�ԣ���ֹFe2����������Fe3��������Fe2��ʱ��Ҫ�������������ۻ���м��
Fe3O4+4H2����2��ʯ���������������۵����壬����������ˮ�����ĽӴ������Ϊ��ֹҺ��ı��У������ƿ��Ӧ���ȼ����ʯ�����Ƭ����3������ҺB�еμ�KSCN��Һ����Һ��죬˵����ҺB�к���Fe3��������������һ������Fe3O4�����ܺ�������û�з�Ӧ��Fe�������Һ����죬˵����Һ�в���Fe3��������������һ������Fe3O4��Fe����4��Fe3O4�����ᷴӦ����Fe3����Fe2����Fe��Fe3��������Ӧ��Fe��2Fe3��=3Fe2������5������NaOH���ְ�ɫ��������ɫ����ΪFe(OH)2������FeSO4��2NaOH=Fe(OH)2����Na2SO4��Ѹ��ת��ɻ���ɫ������Ϊ���ɫ��������ΪFe(OH)2������������Fe(OH)3�������ķ�Ӧ����ʽΪ4Fe(OH)2��O2��2H2O=4Fe(OH)3����6����4����δ������Һ��죬˵��Fe2��������������Fe3��������Fe2���Ļ�ԭ�ԣ���ֹFe2����������Fe3��������Fe2��ʱ��Ҫ�������������ۻ���м��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���÷���A����������B����������C�������������D��������������E�����Ӳ�������д���и��ա�
��1��ԭ��������_____������
��2��Ԫ�ص�������_____����
��3��Ԫ�صĻ��ϼ���Ҫ��____����
��4���˵������_____������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��һ����Ҫ�Ļ���ԭ�ϣ���ʯ���ѽ�������Ҫ�ɷ֣�A�IJ�������������һ�����ҵ�ʯ�ͻ���ˮƽ��D�ķ���ʽΪC2H4O2����ǿ�ҵĴ̼�����ζ��E�Ǿ��й�����ζ��Һ�塣A��B��C��D��E��һ�������´�������ת����ϵ�����ַ�Ӧ���������ﱻʡ�ԣ���
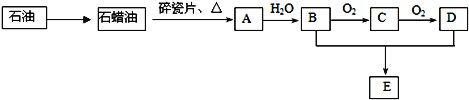
��ش��������⣺
��1����ҵ�ϣ���ʯ�ͻ��ʯ���͵ķ�����__________________��
��2����������ʯ���ͻ��A�Ĺ����е��м����֮һ������һ��ͬ���칹���к�����������CH3 ����������ͬ���칹��Ľṹ��ʽ�ǣ�___________________��
��3��C�Ľṹ��ʽΪ______________________��D�����й����ŵ�������_______________��
��4����ӦB �� C�Ļ�ѧ����ʽΪ______________________����ӦB��D��E�Ļ�ѧ����ʽΪ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܱ������У���H2��COֱ���Ʊ������ѣ�CH3OCH3��������̰������·�Ӧ��
i.CO(g)+2H2(g) ![]() CH3OH(g) H1=90.1kJ��mol1
CH3OH(g) H1=90.1kJ��mol1
ii.2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) H2=24.5kJ��mol1
CH3OCH3(g)+H2O(g) H2=24.5kJ��mol1
������������ͬʱ����H2��COֱ���Ʊ������ѵķ�Ӧ�У�COƽ��ת����������X �ı仯��������ͼ��ʾ������˵����ȷ����( )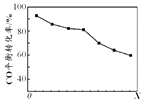
A.��H2��COֱ���Ʊ������ѵķ�ӦΪ���ȷ�Ӧ
B.����XΪѹǿ
C.X�������ѵIJ���һ������
D.X���÷�Ӧ��ƽ�ⳣ��һ����С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ������ȤС��Ϊ̽��ͭ��Ũ����ķ�Ӧ���������ͼ��ʾװ�ý������й�ʵ�飺
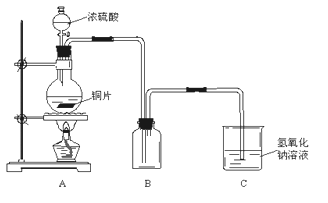
��1��ʵ��������ȡ6��4gͭƬ��12mL 18mol��L��1Ũ�������Բ����ƿ�й��ȣ�ֱ����Ӧ��ϣ��������ƿ�л���ͭƬʣ�࣬��С��ѧ��������ѧ�Ļ�ѧ֪ʶ��Ϊ����һ����������ʣ�ࡣ
����д��ͭ��Ũ���ᷴӦ�Ļ�ѧ����ʽ��___________________________________________
��Ϊʲô��һ���������ᵫδ��ʹͭƬ��ȫ�ܽ⣬����Ϊԭ���ǣ�____________________��
������ҩƷ���ܹ���֤����Ӧ���������ƿ��ȷ��������ǣ�________����д��ĸ��ţ���
A������ B���Ȼ�����Һ C������ D��̼��������Һ
��2��Ϊ�����ⶨ��������ʵ���Ũ�ȣ�ijλͬѧ������������ƣ��Ȳⶨͭ��Ũ���ᷴӦ����SO2�������ټ�����������ʵ���Ũ�ȡ�����Ϊ�ⶨSO2�����ķ����ж��֣���������ʵ�鷽���п��е���__________����д��ĸ��ţ������м������������ʵ���Ũ�ȱ�ʵ��ƫ�ߵ���_______________����д��ĸ��ţ�
A����װ��A���������建��ͨ��Ԥ�ȳ�������ʢ�м�ʯ�ҵĸ���ܣ�������Ӧ���ٴγ���
B����װ��A���������建��ͨ��������ϡ�����ữ�ĸ��������Һ���ټ��������Ȼ�����Һ�����ˡ�ϴ�ӡ������������
C������ˮ���ⶨװ��A��������������������ɱ�״����
D����װ��A���������建��ͨ����������������Һ����Ӧ��ȫ���ˡ�ϴ�ӡ������������
E����װ��A���������建��ͨ�����������ữ�����ᱵ��Һ����Ӧ��ȫ���ˡ�ϴ�ӡ����������������֪���������ǿ�����ԣ�
��A����У���д���Ľ��ķ�����___________________����A�������ÿ�д�����øĽ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����A������Al2(SO4)3��Al2O3��Fe2O3����һ�������¿�ʵ����ͼ��ʾ�ı仯��

��ش��������⡣
��1��B��C��D��E 4�����ʵĻ�ѧʽΪ��
B____________��C____________��D____________��E____________��
��2������F��NaOH��Һ��Ӧ�����ӷ���ʽΪ________________________________��
����E��ϡ���ᷴӦ�����ӷ���Ϊ____________________________________��
��ҺG�����ϡ��ˮ��Ӧ�Ļ�ѧ����Ϊ________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�Ϊ2L���ܱ����г���2molA�����1molB���壬��һ�������·������·�Ӧ��2A��g��+B��g��3C��g������2s��ﵽƽ�⣬���C�����Ũ��Ϊ0.6molL��1 �� ����˵������ȷ���ǣ� ��
��������A��ʾ�÷�Ӧ��ƽ����Ӧ����Ϊ0.2molL��1s��1
��������B��ʾ�÷�Ӧ��ƽ����Ӧ����Ϊ0.2molL��1s��1
��ƽ��ʱ����A��B��ת�������
��ƽ��ʱ����B��Ũ��Ϊ0.2molL��1
�������������䣬���������ټ���1molC���壬�ﵽ��ƽ��ʱ��C������������䣮
A.�٢ڢ�
B.�٢ۢ�
C.�ڢܢ�
D.�٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ��ʯ�ͷ�������ʾ��ͼ��a��b��c��������У� �� 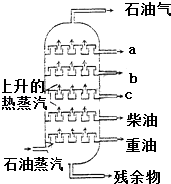
A.a�ķе����
B.b���۵����
C.c��̼ԭ�������
D.ÿһ����ֶ��Ǵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ˮ�к���CN-��Cr2O72-���������辭��ˮ��������С���ŷ�����ˮ����������������̽��д���:
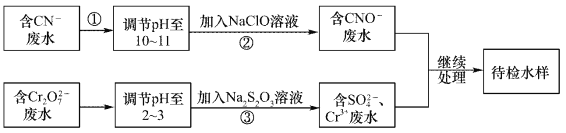
�ش���������:
��1������������CN-��ClO-����ΪCNO-�����ӷ���ʽΪ____________��
��2���������ķ�Ӧ�����˷���ʽΪS2O32-+Cr2O72-+H+��SO42-+Cr3++H2O(δ��ƽ)��ÿ����0.4mol Cr2O72-ʱ����Ӧ��S2O32-ʧȥ_________mol���ӡ�
��3����Cr3+��ˮ���Լ�����ʯ�ҽ�һ��������Ŀ����___________________��
���𰸡� CN��+ClO�� = CNO��+Cl�� 2.4 ���ڷ�ˮpH��ʹ��ת��ΪCr(OH)3������ȥ
����������1��������У�CN-��ClO-����ΪCNO-����Ϊ���ڼ��Ի����У�����ClO��ֻ�ܱ���ԭΪCl������˷�Ӧ�����ӷ���ʽΪCN��+ClO�� = CNO��+Cl������2�����ݷ���ʽ��֪���ڷ�Ӧ��CrԪ�صĻ��ϼ۴ӣ�6�۽��͵���3�ۣ��õ�3�����ӣ�����0.4 mol Cr2O72-ת��ΪCr3��ʱת�Ƶ��ӵ����ʵ�����0.4mol����6��3����2��2.4mol����3����ʯ����ǿ�����ˮ�Լ��ԣ����Ժ�Cr3+��ˮ�м�����ʯ�ҽ�һ��������Ŀ���ǵ��ڷ�ˮpH��ʹ��ת��ΪCr(OH)3������ȥ��
�����͡�������
��������
30
����Ŀ����ʪ��������ĸ���Ʒ������(H2SiF6)������ˮ������Ĺ�����ͼ��ʾ:

��֪�������(K2SiF6)����,����ʪ�ԣ�����ˮ,�����ھƾ���
��1��д����Ӧ���еĻ�ѧ����ʽ:________________��
��2����ʵ���ҹ��˲��������õIJ���������_____________����ϴ�ӷ������(K2SiF6)ʱ���þƾ�ϴ��,��Ŀ����:____________��
��3������������Щ���ʿ���ѭ��ʹ��:_____________��(�û�ѧʽ����)
��4����������Ը�ʴ�̻��������ڿ�ʴ����������Ҳ������H2SiF6,��д���÷�Ӧ�Ļ�ѧ����ʽ:__________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com