
【题目】某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置进行了有关实验:
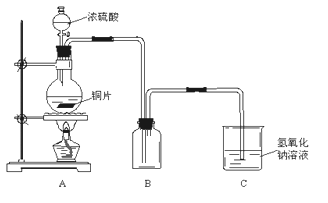
(1)实验中他们取6.4g铜片和12mL 18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①请写出铜跟浓硫酸反应的化学方程式:___________________________________________
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是:____________________。
③下列药品中能够用证明反应结束后的烧瓶中确有余酸的是:________(填写字母编号)。
A.铁粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液
(2)为定量测定余酸的物质的量浓度,某位同学进行了如下设计:先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度。他认为测定SO2的量的方法有多种,请问下列实验方案中可行的是__________(填写字母编号)。其中计算结果余酸物质的量浓度比实际偏高的是_______________(填写字母编号)
A.将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量
B.将装置A产生的气体缓缓通入足量用稀硫酸酸化的高锰酸钾溶液,再加入足量氯化钡溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况)
D.将装置A产生的气体缓缓通入足量氢氧化钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀
E.将装置A产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀(已知:硝酸具有强氧化性)
若A项不可行,请写出改进的方法:___________________(若A项可行则该空写“不用改进”)
【答案】 ①Cu + 2H2SO4(浓)![]() CuSO4+ SO2↑+ 2H2O 随着反应进行,硫酸被消耗,且产物有水生成,所以浓硫酸变成稀硫酸,反应会停止 AD E C A产生的气体先经浓硫酸干燥,后用碱石灰吸收
CuSO4+ SO2↑+ 2H2O 随着反应进行,硫酸被消耗,且产物有水生成,所以浓硫酸变成稀硫酸,反应会停止 AD E C A产生的气体先经浓硫酸干燥,后用碱石灰吸收
【解析】(1)①铜跟浓硫酸加热反应生成硫酸铜和二氧化硫等;正确答案:Cu + 2H2SO4(浓)![]() CuSO4+ SO2↑+ 2H2O;
CuSO4+ SO2↑+ 2H2O;
②随着反应进行,硫酸被消耗,且产物有水生成,所以浓硫酸变成稀硫酸,铜与稀硫酸不反应,反应会停止;正确答案:随着反应进行,硫酸被消耗,且产物有水生成,所以浓硫酸变成稀硫酸,反应会停止;
③金属铁与稀硫酸反应产生气体,A正确;溶液中有硫酸铜和稀硫酸,硫酸根离子都能与钡离子反应生成硫酸钡沉淀,无法证明结论;B错误;银与稀硫酸不反应,没有现象,无法证明;C错误;碳酸氢钠溶液与稀硫酸反应生成二氧化碳气体,D正确;正确选项:AD;
(2)SO2中混有水蒸气,碱石灰也吸收水蒸气,SO2的量偏大,测定余酸物质的量浓度偏小;A错误;
SO2能够被稀硫酸酸化的高锰酸钾溶液氧化为硫酸根离子,与氯化钡溶液反应生成沉淀,稀硫酸中还有硫酸根离子,SO2的量偏大,根据硫原子守恒规律,所测余酸物质的量浓度偏小;B错误;
SO2以1:40溶解于水,且和水发生反应,SO2的量偏小,根据硫原子守恒规律,所测余酸物质的量浓度偏大,C错误;
SO2气体与氢氧化钡溶液反应,生成亚硫酸钡沉淀,该沉淀在空气中易被氧化为硫酸钙,导致固体质量增加,SO2的量偏大,根据硫原子守恒规律,测定余酸物质的量浓度偏小; D错误;
SO2被硝酸氧化为硫酸根离子,然后再与钡离子结合生成硫酸钡沉淀,反应完全后,过滤、洗涤、干燥、称量沉淀,结果准确;E正确;
正确选项:E;C;
A项中主要是水蒸气被碱石灰吸收带来的误差,导致所测SO2的含量增大,所以要除去水蒸气,用浓硫酸即可;正确答案:A产生的气体先经浓硫酸干燥,后用碱石灰吸收;


科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果不正确的是
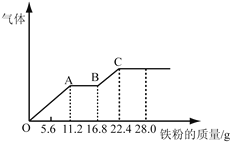
A. 混合酸中HNO3物质的量浓度为2mol/L
B. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
C. 原混合酸中H2SO4物质的量为0.4 mol
D. 第二份溶液中最终溶质为FeSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于硫化氢气体在空气中完全燃烧的产物,下列叙述正确的是
①具有臭鸡蛋气味的气体 ②是淡黄色的固体
③是无色有刺激性气味的气体 ④是造成酸雨的主要物质
A.②B.③C.①④D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置的说法中正确的是( )
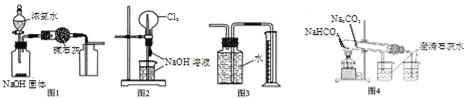
A. 图1装置可制取、收集干燥纯净的NH3
B. 图2装置可以完成“喷泉”实验
C. 图3装置可测量Cu 与浓硝酸反应产生气体的体积
D. 图4装置可用比较NaHCO3和Na2CO3的热稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)xC(g) , 有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( ) 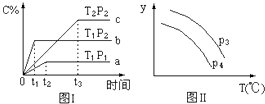
A.P3>P4 , y轴表示B的转化率
B.P3<P4 , y轴表示B的体积分数
C.P3<P4 , y轴表示混合气体的密度
D.P3<P4 , y轴表示混合气体的平均摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。 请回答该实验中的问题。
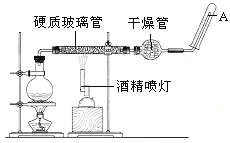
(1)写出该反应的化学方程式__________________________________________。
(2)玻璃管中石棉绒的作用是__________________________________,圆底烧瓶中盛装水,烧瓶里应事先放置_________________,其作用是______________。
(3)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分是_______________________,若溶液未变红色则说明硬质试管中固体物质的成分是_______________________。
(4)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是___________________(用离子方程式表示)。
(5)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关的反应的化学方程式_____________________________ ,________________________。
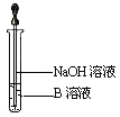
(6)一段时间后,该同学发现(4)中未变红的溶液变成红色,说明Fe2+ 具有____性。由此可知,实验室中含Fe2+的盐溶液需要现用现配制,并且配制含Fe2+的盐溶液时应加入少量____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中不能用化合反应的方法制得的是( )
①SiO2 ②H2SiO3 ③Fe(OH)3 ④Al(OH)3 ⑤FeCl2 ⑥CaSiO3
A. ①③ B. ②④
C. ②③④⑤ D. ②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质转化关系如下图,已知A是一种常见金属,F是一种红褐色沉淀。回答下列问题。
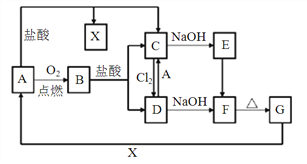
(1)A的化学式为_______;
(2)实验室保存C溶液时需加少量固体A,目的是_____________________。B与盐酸反应的离子方程式为_____________________________。
(3)检验C溶液中阳离子常用的方法是______________________________。
(4)E的浊液在空气中会变质生成F,对应现象为_______________________________ 。
(5)向C中加入Na2O2也可实现C向D和F的转化,Na2O2完全被还原。反应的离子方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组准备在实验室配制95mL1.0mol/L的硝酸溶液,然后再研究金属铜与硝酸的反应情况。
(1)配制95mL1.0mol/L的硝酸溶液,需要的仪器除烧杯、玻璃棒、量筒、胶头滴管外,还需要的玻璃仪器是_____________。
(2)若用10mol/L的浓硝酸来配制上述溶液,需要量取浓硝酸的体积是_________mL。
(3)配制过程中,下列操作会引起浓度偏小的是________。
A,.定容摇勾后发现液面低于刻度线,再加水至刻度线
B.定容时俯视容量瓶的刻度线
C.将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就进行定容操作
D.容量瓶用蒸馏水洗涤后未烘干
E.量取浓硝酸后,用少量蒸馏水洗涤量筒并将洗涤液也放入烧杯
(4)课外小组同学将制得的硝酸与铜片在下列装置中反应,反应初期观察到大试管中的液体a逐渐变为蓝色,试管上方有浅红棕色气体出现。
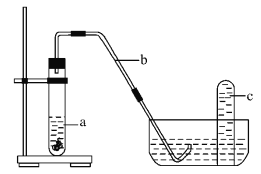
①反应初期液体a逐渐变为蓝色是由于反应生成了_________(填化学式)。
②请解释反应初期试管上方有浅红棕色气体出现的理由_________ (结合化学方程式说明)。
③导致红棕色气体在试管c中颜色消失的反应方程式为_________。
【答案】 100mL容量瓶 10.0 AC Cu(NO3)2 装置中有空气,将NO气体氧化为红棕色的NO2 气体,2NO+O2 = 2NO2 3NO2+H2O = 2HNO3+NO
【解析】(1)实验室没有95mL规格的容量瓶,必须配制100mL,配制100mL1.0molL-1的硝酸溶液步骤为:计算、称量、溶解冷却、移液、洗涤、定容、摇匀、装瓶,用到的玻璃仪器有:烧杯、玻璃棒、100ml容量瓶、胶头滴管,所以需要的玻璃仪器是:100mL容量瓶;(2)配制100mL1.0molL-1的硝酸溶液,设需要10molL-1的浓硝酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:100mL×1.0molL-1=10molL-1×V,解得V=10mL;(3)A.定容摇匀后发现液面低于刻度线,再加水至刻度线,导致溶液体积偏大,溶液浓度偏低,选项A选;B.定容时俯视容量瓶的刻度线,导致溶液体积偏小,溶液浓度偏低,选项B不选;
C.将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就进行定容操作,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,选项C选;D.容量瓶用蒸馏水洗涤后未烘干,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,选项D不选;E.量取浓硝酸后,用少量蒸馏水洗涤量筒并将洗涤液也放入烧杯,则相当于所量硝酸偏多,导致所配溶液浓度偏大,选项E不选。答案选AC;(4)①铜与硝酸反应生成硝酸铜,化学式为Cu(NO3)2;②装置中有空气,将NO气体氧化为红棕色的NO2 气体,2NO+O2 = 2NO2,即使开始没有NO2而只有NO气体也可能变成红棕色,反应初期试管上方有浅红棕色气体出现;
③二氧化氮能够与水反应生成硝酸和一氧化氮,反应方程式:3NO2+H2O = 2HNO3+NO,所以红棕色气体在试管c中颜色消失。
点睛:本题考查了一定物质的量浓度溶液的配制及硝酸性质探究,明确配制原理及操作步骤,熟悉硝酸的性质是解题关键,易错点为(4)①铜与硝酸反应生成硝酸铜,硝酸铜为蓝色溶液;②依据一氧化氮能够与空气中氧气反应生成二氧化氮解答;③依据二氧化氮能够与水反应生成硝酸和一氧化氮解答。
【题型】综合题
【结束】
29
【题目】某废水中含有CN-和Cr2O72-等离子,需经污水处理达标后小能排放,污水处理拟采用下列流程进行处理:

回答下列问题:
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为____________。
(2)步骤③的反应的离了方程式为S2O32-+Cr2O72-+H+→SO42-+Cr3++H2O(未配平),每消耗0.4mol Cr2O72-时,反应中S2O32-失去_________mol电子。
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com