
【题目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果不正确的是
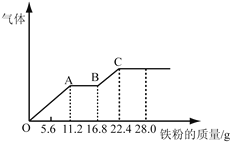
A. 混合酸中HNO3物质的量浓度为2mol/L
B. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
C. 原混合酸中H2SO4物质的量为0.4 mol
D. 第二份溶液中最终溶质为FeSO4
【答案】C
【解析】试题分析:某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体)。由铜与稀硝酸反应的离子方程式3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O可知,n(HNO3)=![]() 。由图可知,向另一份中逐渐加入铁粉, OA段发生Fe+NO3-+4H+=Fe3++NO↑+2H2O,n(Fe)= n(Fe3+)= n(HNO3)=
。由图可知,向另一份中逐渐加入铁粉, OA段发生Fe+NO3-+4H+=Fe3++NO↑+2H2O,n(Fe)= n(Fe3+)= n(HNO3)=![]() ;AB段的反应为Fe+2Fe3+=3Fe2+,这阶段溶解的铁的物质的量为
;AB段的反应为Fe+2Fe3+=3Fe2+,这阶段溶解的铁的物质的量为![]() n(Fe3+)=0.1mol;BC段又产生气体,故此阶段的反应为Fe+2H+= Fe2++H2↑。A. 混合酸中HNO3物质的量浓度为
n(Fe3+)=0.1mol;BC段又产生气体,故此阶段的反应为Fe+2H+= Fe2++H2↑。A. 混合酸中HNO3物质的量浓度为![]() 2mol/L。A正确;B. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气,B正确;C. 由图像可知,每份混酸最多可溶解22.4gFe生成FeSO4溶液,由Fe守恒可知,原混合酸中H2SO4物质的量等于铁的物质的量的2倍(因为共分为2等份),即
2mol/L。A正确;B. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气,B正确;C. 由图像可知,每份混酸最多可溶解22.4gFe生成FeSO4溶液,由Fe守恒可知,原混合酸中H2SO4物质的量等于铁的物质的量的2倍(因为共分为2等份),即![]() =0.8 mol,C不正确;D. 第二份溶液中最终溶质为FeSO4,D正确。本题选C。
=0.8 mol,C不正确;D. 第二份溶液中最终溶质为FeSO4,D正确。本题选C。


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】有机物A只含有C、H、O三种元素,且它们的质量比为9:2:4;A的核磁共振氢谱显示有四种不同类型的氢原子.物质D是一种芳香族化合物,请根据如图(所有无机产物已略去)中各有机物的转化关系回答问题. RCHO+R′CH2CHO ![]()
![]() +H2O
+H2O
已知,两分子醛在一定条件下可以发生如下反应(其中R、R′为H或烃基):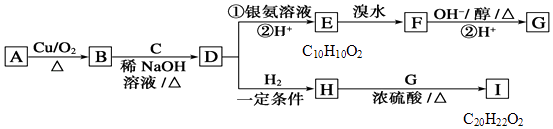
(1)写出质A的名称:;C的结构简式:;E中含氧官能团的名称: .
(2)写出下列反应的有机反应类型:A→B; D→H .
(3)写出H到I的化学方程式: .
(4)写出D到E过程中的①的反应化学方程式: .
(5)1molF与足量的氢氧化钠水溶液反应最多消耗mol NaOH.
(6)根据题中信息,G的可能结构为种.
(7)请写出符合下列条件的E的同分异构体的结构简式 . i.该物质水解产物之一为乙酸; ii.苯环上的一氯代物只有两种结构.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】席夫碱类化合物G在催化、药物、新材料等方面有广泛应用.合成G的一种路线如下: 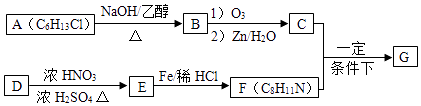
已知以下信息:
① 
![]() R1CHO+
R1CHO+ 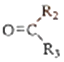
②1mol B经上述反应可生成2mol C,且C不能发生银镜反应
③D属于单取代芳烃,其相对分子质量为106
④核磁共振氢谱显示F苯环上有两种化学环境的氢原子
⑤RNH2+ 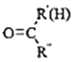
![]()
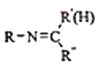 +H2O
+H2O
回答下列问题:
(1)C中官能团名称 , D的化学名称 .
(2)由A生成B的化学方程式为 .
(3)G的结构简式为 .
(4)F的同分异构体中含有苯环的还有种(不考虑立体异构),其中核磁共振氢谱有4组峰,且面积比为6:2:2:1的是(写出其中一种的结构简式).
(5)由苯及化合物C经如下步骤可合成N﹣异丙基苯胺: ![]()
![]() H
H ![]() I
I ![]() J
J ![]()
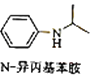
反应条件1所选择的试剂为 , H→I的反应类型为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图装置的叙述,正确的是( ) 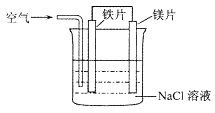
A.镁片为负极,镁片上产生黄绿色气体
B.铁片为阳极,铁片上产生无色气体
C.溶液中铁片与镁片之间产生白色沉淀
D.溶液的pH将逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于四个图象的说法正确的是( ) 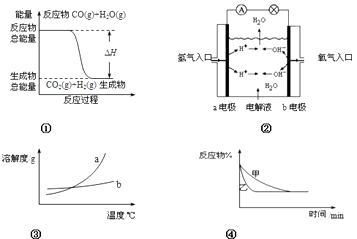
A.图①表示化学反应中能量的变化,反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H>0
B.图②为氢氧燃料电池示意图,正、负极通入的气体体积之比为2:1
C.图③表示物质a、b的溶解度曲线,可以用结晶方法从a、b混合物中提纯a
D.图④可以表示压强对可逆反应2A(g)+2B(g) ![]() 3C(g)+D(s)的影响,且乙的压强大
3C(g)+D(s)的影响,且乙的压强大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用符号A:质子数,B:中子数,C:核外电子数,D:最外层电子数,E:电子层数,填写下列各空。
(1)原子种类由_____决定。
(2)元素的种类由_____决定
(3)元素的化合价主要由____决定
(4)核电荷数由_____决定。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如右图所示。已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1。请回答下列问题:
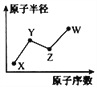
(1)写出四种元素的元素符号:X____ Y____ Z____ W____
(2)HYO3的酸性比HWO强,有人据此认为Y的非金属性强于W,你认为这种看法是否正确___,说明理由__________________________________。
(3)甲和乙分别是由W、X、Y、Z四种元素中的三种元素组成的常见化合物,化合物甲具有漂白消毒杀菌作用,其化学式为________;化合物乙是一种常见的强酸,会因保存不当而变成黄色液体,其原因是_______________________________。把红热的木炭投入黄色液体,剧烈反应,方程式为_____________________,将产生的气体通过澄清石灰水时气体变为无色,但未见有浑浊现象,原因是______________。(写出有关反应的化学方程式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.三氧化二铁可以用来制作油漆
B.可用超纯硅制造的单晶硅来制造计算机的芯片
C.实验室用二氧化锰和浓盐酸共热制取少量氯气
D.氢氧化钠溶液要盛放在磨口玻璃塞的试剂瓶里
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置进行了有关实验:
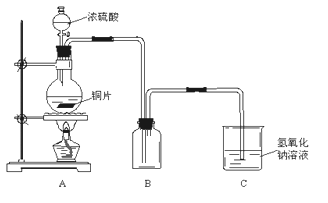
(1)实验中他们取6.4g铜片和12mL 18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①请写出铜跟浓硫酸反应的化学方程式:___________________________________________
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是:____________________。
③下列药品中能够用证明反应结束后的烧瓶中确有余酸的是:________(填写字母编号)。
A.铁粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液
(2)为定量测定余酸的物质的量浓度,某位同学进行了如下设计:先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度。他认为测定SO2的量的方法有多种,请问下列实验方案中可行的是__________(填写字母编号)。其中计算结果余酸物质的量浓度比实际偏高的是_______________(填写字母编号)
A.将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量
B.将装置A产生的气体缓缓通入足量用稀硫酸酸化的高锰酸钾溶液,再加入足量氯化钡溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况)
D.将装置A产生的气体缓缓通入足量氢氧化钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀
E.将装置A产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀(已知:硝酸具有强氧化性)
若A项不可行,请写出改进的方法:___________________(若A项可行则该空写“不用改进”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com